SK바이오팜, '급성중첩발작 신약' 기술수출 해지 FDA 신약허가 앞두고 임상 중단, 아코다社와 권리반환 등 논의
이윤재 기자공개 2017-08-11 08:10:45
이 기사는 2017년 08월 10일 14:17 thebell 에 표출된 기사입니다.
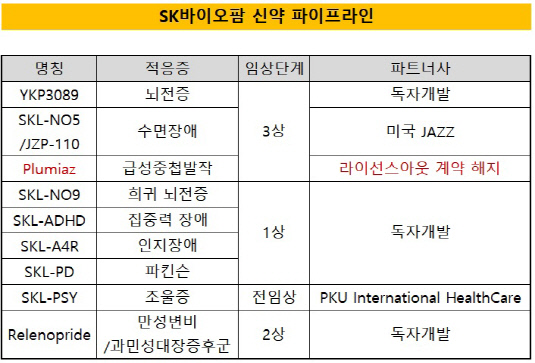
SK㈜ 자회사인 SK바이오팜의 신약 포트폴리오인 급성중첩발작 치료제 '플루미아즈(Plumiaz)'에 대한 기술수출(라이선스 아웃) 계약이 해지됐다. 미국 식품의약국(FDA)에 신약허가(NDA)가 예상됐지만 임상 결과 동등성 입증이 어려울 것을 예상해 미국 파트너사가 계약 해지를 요구했다.10일 바이오업계에 따르면 SK바이오팜은 미국 나스닥 상장기업인 '아코다 테라퓨틱스(Acorda Therapeutics)'와 체결한 플루미아즈 라이선스 아웃 계약이 해지됐다. 양사는 현재 계약해지에 따라 권리반환 등 남은 절차를 협의 중인 것으로 알려졌다.
플루미아즈는 급성중첩발작 치료제로 미국 시장 진출이 임박했던 포트폴리오다. SK바이오팜은 지난 2010년 미국 바이오기업인 '뉴로넥스(Neuronex)'와 라이선스 아웃 계약을 맺었다. 해당 계약에는 국내 등 일부 아시아를 제외한 나머지 국가에 대한 권리양도가 포함됐다. 지난 2012년 아코다가 뉴로넥스를 인수하면서 계약 상대방이 바뀌었다. SK바이오팜은 국내 상업화를 위해 제약사인 한미약품과 파트너십 계약을 맺었다.
SK바이오팜은 플루미아즈 개발 정도에 따라 마일스톤비로 최대 800만 달러를 지급받기로 했다. 이와 별개로 플루미아즈가 상업화를 시작하면 순매출액에 대해 일정 비율(4~6%)로 수익을 분배받는 러닝로열티 조항도 삽입했다. 플루미아즈는 상업화에만 성공하면 미국에서만 연간 순매출액이 2억 달러를 넘을 것으로 예상되는 약물이었다.
플루미아즈는 SK바이오팜이 보유한 신약 포트폴리오 중에서도 개발 속도가 가장 빨랐다. 아코다는 2013년 FDA에 플루미아즈의 NDA를 제출했다. 하지만 이듬해 FDA로부터 검토완료공문(CRL)을 받았다. 제출된 자료만으로는 NDA가 어렵다는 내용이었던 것으로 보인다.
아코다는 FDA와 논의 끝에 지난해 플루미아즈 안전성, 생체이용률 등에 대한 임상을 시작했다. NDA를 다시 제출하는 시기는 2017년 1분기로 잡았다. 하지만 임상 결과 동등성을 입증하기 힘들다고 판단해 아코다는 플루미아즈 개발을 포기했다. 개발이 멈추면서 SK바이오팜과의 라이선스 아웃 계약도 해지됐다.
SK바이오팜은 플루미아즈 외에 나머지 포트폴리오인 뇌전증 치료제 'YKP3089', 수면장애 신약 'SKL-NO5'가 연내 미국 시장 진출을 준비하고 있다.
SK㈜ 관계자는 "아코다측과 계약 종료에 따른 추가 협의가 진행 중이라 아직 정해진 바는 없다"며 "나머지 신약 포트폴리오들은 계획대로 진행 중"이라고 말했다.
|
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- 삼양라운드스퀘어 오너 3세, 신사업 매진 '역할 변경'
- 수출입은행, 상반기 출자사업에 14곳 출사표
- 카카오, 2억달러 교환사채 발행 '공식화'
- [Red & Blue]수급 몰리는 피제이메탈, 알루미늄 시세 급등 '수혜'
- 이에이트, 가천대·길병원과 '디지털 트윈 병원' 구축 MOU
- [멀티플렉스 재무 점검]베트남만 남은 롯데시네마 해외사업
- [뮤지컬 제작사 열전]EMK컴퍼니, 고속성장 비결은 '대기업과 10년 동맹'
- 모트롤 인수 추진하는 두산그룹, 3년 전과 달라진 건
- [LG화학의 변신]패착된 NCC 증설, 자산 유동화 '제값 받기' 관건
- [캐시플로 모니터]포스코인터 '조단위 투자' 거뜬한 현금창출력