부광약품 자회사, 전립선암 치료제 국내 임상 1상 승인 다이나세라퓨틱스 SOL-804, 복용 편의성 높이고 스테로이드 우려 낮춰
최은수 기자공개 2021-10-22 08:23:25
이 기사는 2021년 10월 21일 13:46 thebell 에 표출된 기사입니다.
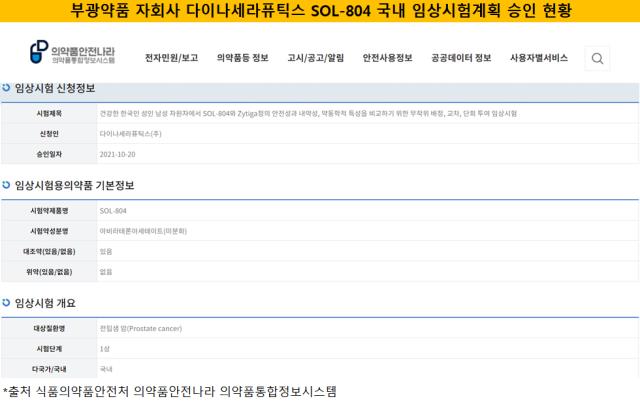
부광약품이 식품의약품안전처로부터 전립선암 치료제 SOL-804 국내 임상 1상 시험계획(IND)을 승인받았다.21일 식품의약품안전처 의약품안전나라 의약품통합정보시스템 현황에 따르면 부광약품의 자회사인 다이나세라퓨틱스는 전립선암 치료제 SOL-804에 대한 임상시험계획을 식약처로부터 공식 승인을 받았다. SOL-804는 부광약품이 덴마크 소재 바이오벤처였던 솔루랄 파마(Solural Pharma)로부터 확보한 항암제 후보물질이다.
부광약품은 2016년 6월 SOL-804를 자회사 다이나세라퓨틱스를 통해 신규 파이프라인으로 편입한 이후 약 5년 만에 국내 임상에 돌입하는 성과를 냈다. 부광약품은 솔루랄 파마로부터 기술 및 개발 판권을 이전 받기 위해 다이나세라퓨틱스를 100% 자회사로 설립하고 SOL-804에 대한 라이선스를 취득했다. 계약비용은 외부에 공개되지 않았다.
다이나세라퓨틱스는 SOL-804에 기존 항암제 대비 적은 용량으로 항암 효과를 내는 약물전달 플랫폼 기술(DDS)을 접목시켰다. 더불어 환자가 섭취한 음식물에 대한 영향을 회피하는 기전으로 복용 편의성과 약물 순응도를 높였다. 기존 전립선암 치료제의 경우 스테로이드성분이 포함돼 있는데 SOL-804는 비스테로이드 기반 제제인 점도 강점이다.
부광약품은 국내 1상 승인과 더불어 SOL-804의 임상을 글로벌로 확장해 시장 진출을 노리고 있다. 전립선암 치료제 시장은 인구 고령화에 영향을 받아 시장 규모나 성장성이 큰 분야로 꼽힌다. 2019년 시장 규모는100억 달러를 넘어섰다. 연평균 8%씩 성장해 2026년엔 20조원을 넘어설 것으로 전망된다.
부광약품 관계자는 "그간 성장가능성이 높은 신약 후보물질들을 발굴해온 임상개발의 성과가 나오기 시작했다"며 "SOL-804의 국내 임상에 이어 글로벌 임상에도 돌입할 계획"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- 박셀바이오, 진행성 간세포암 타깃 'Vax-NK' 특허 출원
- 베니스 비엔날레, 30년만에 두발로 선 '곽훈'의 의미
- [대기업 프로스포츠 전술전략]'모기업발 숙제' 엔씨다이노스, 당분간 긴축 불가피
- 하이브, '민희진 없는' 어도어 경쟁력 입증할까
- SK 오너가 3세 최성환의 '승부수'
- 어느 수집가의 꿈 '이건희 컬렉션'
- [코스닥 리빌딩 리포트]'비상장사 투자 손실' 비투엔, 신사업 '삐걱'
- 유진운용, 공모주-미국 장기채 혼합 펀드 출시
- [우리은행 글로벌그룹 대수술]연체율 치솟는 캄보디아 법인, 방카슈랑스 돌파구 될까
- [우리은행 글로벌그룹 대수술]쿠펜대출 발목잡힌 인니법인, 타개책 '파생상품 확장'
최은수 기자의 다른 기사 보기
-
- 박셀바이오, 진행성 간세포암 타깃 'Vax-NK' 특허 출원
- 뷰노, '비파괴검사' 강자 이번엔 '안저분석' 혁신기기로
- [바이오텍 상장 재도전기]허리띠 졸라맨 벤처 10년, 건강한 비만약 실마리 찾다
- [클리니컬 리포트]티움바이오, TU2218 항암 적응증 '난치암'으로 확립
- 스카이테라퓨틱스, 심재학 엔솔바이오 CFO 영입
- [바이오텍 상장 재도전기]글라세움, 새 기전 '비만치료제' 인체서 반려견 '확장'
- [제약사 TSR 분석]보령, 뜻밖의 우주 주가향방 가른 '소통' 플러스 전환
- '자체 보톡스 균주 확보' 알에프바이오, 원주공장 준공
- [Policy Radar]바이오시밀러 문턱 낮춘 유럽, 비용·경쟁 판이 바뀐다
- 광동제약, 30억 출자 KD헬스바이오 6개월만에 청산





















