[국내 CAR-T 치료제 기업 동향]셀랩메드, CAR-T 치료제로 교모세포종 공략①임상 2상 완료 후 신속 품목 허가 목표로 개발 계획
홍숙 기자공개 2022-01-04 08:22:11
[편집자주]
킴리아, 예스카타, 브레얀지 등 글로벌 제약회사에서 품목허가를 받은 CAR-T 치료제 품목이 5종이다. 국내 기업들도 속속 다양한 차별화 전략으로 CAR-T 치료제 개발에 나서고 있다. 더벨은 국내에서 CAR-T 치료제 연구에 매진하고 있는 주요 기업들의 기술 및 생산 차별화 전략을 들어본다.
이 기사는 2022년 01월 04일 07:15 thebell 에 표출된 기사입니다.
"혈액암이 아닌 고형암(교모세포종)을 타깃으로 국내에서 최초로 임상에 진입한 기업이 될 것이다."2019년 항체의약품과 CAR-T 치료제 개발을 위해 설립된 셀랩메드의 CAR-T 치료제 개발에 주도적 역할을 하는 이송재 연구소장은 이 같은 포부를 밝혔다. 국내에서도 이미 노바티스가 개발한 킴리아가 품목허가와 함께 건강보험 급여등재까지 앞두고 있다.
여기에 큐로셀은 킴리아와 같은 적응으로 국내 기업 최초로 CAR-T 치료제 임상에 진입했다. 셀랩메드는 CAR-T 치료제 개발 분야에서 경쟁력을 갖기 위해선 '고형암' 도전이 필수라고 판단했다. 셀랩메드는 식품의약품안전처로부터 뇌암 환자를 대상으로 하는 CAR-T 치료제 ‘YYB-103(CLM-103)’의 임상시험계획을 지난해 12월 28일자로 승인받았다고 밝혔다.
혈액암 이외에 고형암을 대상으로 한 CAR-T 치료제가 식약처의 임상 승인을 받은 것은 셀랩메드가 국내 최초다. 이번 임상1상은 표준요법에 불응 또는 재발한 악성 뇌교종 환자를 대상으로 CLM-103을 투여하는 방식으로 안전성 및 내약성을 평가하는 임상으로 국립암센터에서 진행할 계획이다.
◇IL13Rα2 타깃으로 종양 특이적 CAR-T 제작한 전임상 결과 확보
셀랩메드는 차별화 된 CAR-T 치료제 개발을 위해 희귀암종에 특이적인 항원 발굴에 주목했다. 고형암 중에서도 희귀암인 '교모세포종(GBM)' 치료제를 개발해 품목허가를 주기를 앞당긴다는 전략이다. 이를 위해 구축한 파이프라인이 'CLM-103'이다. CLM-103은 GBM 특이적 항원 'IL13Rα2'을 타깃으로 하는 CAR-T 치료제 후보물질이다.
이송재 셀랩메드 연구소장은 "임상 1상에서 안정성을 입증하면, 임상 2상 데이터를 통해 조건부허가를 받을 수 있을 것으로 기대한다"며 "지난 9월 식약처에 임상 1상에 대한 임상시험계획(IND)을 제출하였고 임상승인을 받으면 올해부터 1상에 진입해 본격적으로 임상연구를 수행할 것"이라고 내다봤다.
교모세포종은 전 세계 연간 3만6000명의 환자가 발병한다. 수술요법과 화학항암요법 외에 이렇다할 치료법이 없는 상황이다. 로슈가 개발한 아바스틴의 효과 역시 제한적이다. 이런 상황에서 회사는 교모세포종에 특이적인 항원 '인터루킨(IL)13Rα2'에 주목했다.
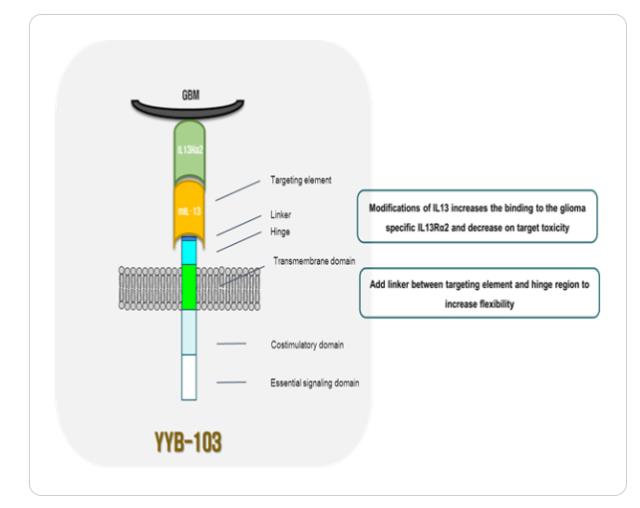
이 연구소장은 "IL13Rα2은 뇌 종양에만 특이적으로 분포하는 것으로 알려진 항원"이라며 "우리가 개발 중인 치료제는 IL13Rα2만 인지하도록 리간드인 IL13을 유전적으로 조작한 CAR 부위가 특징"이라고 설명했다. 회사가 개발 중인 CLM-103은 정상세포는 공격하지 않고, IL13Rα2를 가진 암세포만 공격한다.
회사는 전임상 실험을 통해서 IL13Rα2에만 결합하는 단백질 구조를 발굴해 이를 CAR-T 치료제에 접목했다. 우리 인체의 면역세포에서 생성되는 싸이토카인인 인터류킨 13(IL-13)은 IL13Rα1과 IL13Rα2라는 2가지 형태의 리셉터와 결합하는 것으로 알려져 있다. 이중 정상세포는 IL13Rα1을, 암세포는 IL13Rα2를 항원으로 갖고 있다. CAR-T 치료제가 암세포만을 죽이기 위해서는 IL13Rα2를 인지해야만 하는 이유다.
그는 "우리는 CLM-103의 최적화된 IL-13 CAR 구조가 다양한 전임상 실험을 통해서 IL13Rα1이 발현되는 정상세포에는 영향을 주지 않는다는 데이터를 확보했다"며 "IL13Rα2를 타깃으로 암세포만 공격해 유의미한 효력 데이터 및 안전성 결과를 확인했다"고 밝혔다.
셀랩메드는 임상 1상은 9~18명의 GBM 환자를 대상으로 국립암센터와 협업해 진행한다는 계획이다.
◇정맥투여로 IL13Rα2 타깃하는 차별화로 승부
현재 셀랩메드와 같이 교모세포종을 타깃으로 CAR-T 치료제를 개발 중인 기업은 4곳이다. 이들 기업은 이미 임상 1상을 통해 안전성 데이터를 확보했다. 대표적인 기업이 킴리아 개발 기업으로 잘 알려진 유펜(UPEN)과 노바티스다. 이들은 정맥투여(IV)로 항원 'EGFRvIII'를 타깃으로 하는 CAR-T 치료제 후보물질을 개발 중인 것으로 알려져 있으며, 현재 임상 1상을 마치고 다른 약물과 병용요법 효과를 확인 중이다.
그는 "우리가 타깃으로 하는 IL13Rα2은 GBM 환자의 50~70% 발현된다"며 "유펜 그룹이 타깃으로 하는 항원(EGFRvIII)은 약 20%의 GBM 환자에서 발현하기 때문에, 대상 환자군이 더 넓을 것으로 본다"고 분석했다.
환자 1명에 대한 결과이지만 GBM에서 완전관해(CR)을 보인 CAR-T 치료제 후보물질도 있다. 씨티 오브 호프(City of Hope)와 머스탱바이오(Mustangbio)가 개발 중인 후보물질이다. 물론 많은 환자에서 해당 효과를 아직까지 입증하진 못 했다. 이 곳의 약물 투여법은 뇌실투여(ICV)다.
그는 "우리와 같은 적응증으로 CAR-T 치료제를 개발하고 있는 경쟁그룹들은 임상 1상을 통해 안전성을 입증한 상황"이라며 "우리도 빠르게 임상 1상에 진입해 안전성 확보와 함께 CLM-103의 효력을 극대화할 수 있는 병용 요법 임상도 진행할 것"이라고 말했다.


< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- 스튜디오산타클로스ENT, 주주권익 보호 '구슬땀'
- 이에이트, AI 시뮬레이션·디지털 트윈 기술 선보여
- MBK, '몸값 2조' 지오영 인수 SPA 체결 임박
- [2024 더벨 글로벌 투자 로드쇼-베트남]한인이 설립한 RCE, 세계 첫 ‘중장비 온라인 중고거래’
- 회계법인 해솔, 부동산 타당성 자문 업무협약
- [2024 더벨 글로벌 투자 로드쇼-베트남]베트남의 지오영 '바이메드'·전기오토바이 '셀렉스' 눈길
- 지아이에스, 코스닥 상장 위한 예비심사신청서 제출
- [꿈틀대는 토큰증권 시장]'업계 표준' 루센트블록, '두자릿수' 레코드 조준
- [Company & IB]조달 '막바지' 롯데그룹, 롯데케미칼에 쏠리는 눈
- '910억 CB 발행' 아스트, 경영 정상화 속도 낸다






















