바이로메드 "당뇨합병증 치료제 美 3상 1년내 완료" 임상3상 환자 모집 94% 달성…당뇨병성궤양 치료제, 임상3상 2020년 완료
강인효 기자공개 2018-06-27 13:17:00
이 기사는 2018년 06월 26일 16:45 thebell 에 표출된 기사입니다.
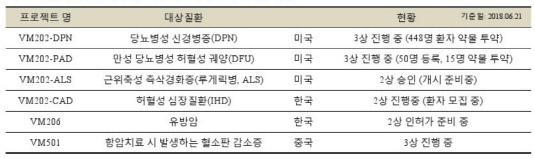
바이로메드가 개발중인 당뇨 합병증 치료제에 대해 내년 상반기 미국 임상 3상 시험을 완료할 전망이다. 바이로메드는 대표적 당뇨합병증인 인 통증성 당뇨병성 신경병증(PDPN) 치료제로 'VM202'를 개발하고 있다. VM202는 만성 당뇨병성 허혈성 궤양(DFU) 치료제로도 적응증을 확대해 개발 중인데, 이 치료제의 미국 임상 3상도 순항하고 있다.26일 바이로메드에 따르면 통증성 당뇨병성 신경병증 치료제로 개발 중인 'VM202-DPN(개발명)'가 지난 21일 기준 미국 임상 3상의 약물투여 진행 피험자수가 448명으로 전체 목표 피험자수(477명)의 94%까지 도달했다. 이 중 9개월간 약물투여 후 추적관찰이 완료된 피험자수는 210명이다.
바이로메드 관계자는 "조만간 VM202-DPN의 임상 환자 모집을 완료하게 되면 마지막 환자의 약물 투여를 진행하게 된다"면서 "9개월이라는 약물투여 후 추적관찰기간을 고려할 때, 내년 상반기 미국 임상 3상을 완료하는 것을 목표로 하고 있으며, 내년 하반기에는 임상 3상 초기 결과를 확인할 수 있을 것"이라고 말했다.
VM202-DPN은 지난 5월 미국 식품의약국(FDA)으로부터 '첨단 재생의약 치료제(RMAT)'로 지정 승인을 받았다. RMAT란 혁신적 치료제를 신속하게 허가해주기 위해 만든 제도다. 회사 측은 VM202-DPN이 통증성 당뇨병성 신경병증을 대상으로 재생의약의 잠재력 요건을 갖춘 약물임을 인정받은 결과로 해석할 수 있다고 설명했다.
또 바이로메드가 만성 당뇨병성 허혈성 궤양 치료제로 개발 중인 'VM202-PAD(개발명)'의 미국 임상 3상도 본 궤도에 오를 것으로 전망된다. 작년 9월 미국 임상 3상에 들어간 VM202-PAD의 경우 지난 21일 기준 10개 기관에서 50명의 환자가 등록했으며, 이 중 15명의 환자에게 약물 투여가 진행됐다. VM202-PAD의 미국 임상 3상은 25개 병원에서 300명을 대상으로 진행하는 것으로 설계돼 있다. 약물투여 후 추적관찰기관은 7개월이다.
회사 관계자는 "오는 8월 25개 병원의 모든 임상시험 책임연구자(PI)들과 함께 '조사자 킥오프 워크숍(Investigator Kick-off)'을 실시할 계획"이라며 "VM202-PAD의 임상 3상은 계획대로 잘 진행되고 있으며, 2020년 임상 3상을 완료하는 것으로 목표로 하고 있다"고 말했다.
|
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 스튜디오산타클로스ENT, 주주권익 보호 '구슬땀'
- 이에이트, AI 시뮬레이션·디지털 트윈 기술 선보여
- MBK, '몸값 2조' 지오영 인수 SPA 체결 임박
- [2024 더벨 글로벌 투자 로드쇼-베트남]한인이 설립한 RCE, 세계 첫 ‘중장비 온라인 중고거래’
- 회계법인 해솔, 부동산 타당성 자문 업무협약
- [2024 더벨 글로벌 투자 로드쇼-베트남]베트남의 지오영 '바이메드'·전기오토바이 '셀렉스' 눈길
- 지아이에스, 코스닥 상장 위한 예비심사신청서 제출
- [꿈틀대는 토큰증권 시장]'업계 표준' 루센트블록, '두자릿수' 레코드 조준
- [Company & IB]조달 '막바지' 롯데그룹, 롯데케미칼에 쏠리는 눈
- '910억 CB 발행' 아스트, 경영 정상화 속도 낸다