비디아이 "엘리슨, '글루포스파미드' 임상 3상 정상화" 미국 16개 지역·22개 기관 480명 대상, 코로나19로 지연…ILC 중국 2상 이어 FDA 승인 대기
신상윤 기자공개 2021-05-10 15:37:19
이 기사는 2021년 05월 10일 15:34 thebell 에 표출된 기사입니다.
코스닥 상장사 비디아이는 10일 코로나19로 지연됐던 미국 '엘리슨파마슈티컬스(엘리슨)' 췌장암 치료 신약인 '글루포스파미드' 임상 3상이 정상화됐다고 밝혔다.엘리슨이 정기보고회를 통해 알린 이 소식은 글루포스파미드에 대한 임상 완료와 FDA 신약 등록 등으로 늦어도 오는 2023년 판매까지도 기대되는 상황이다.
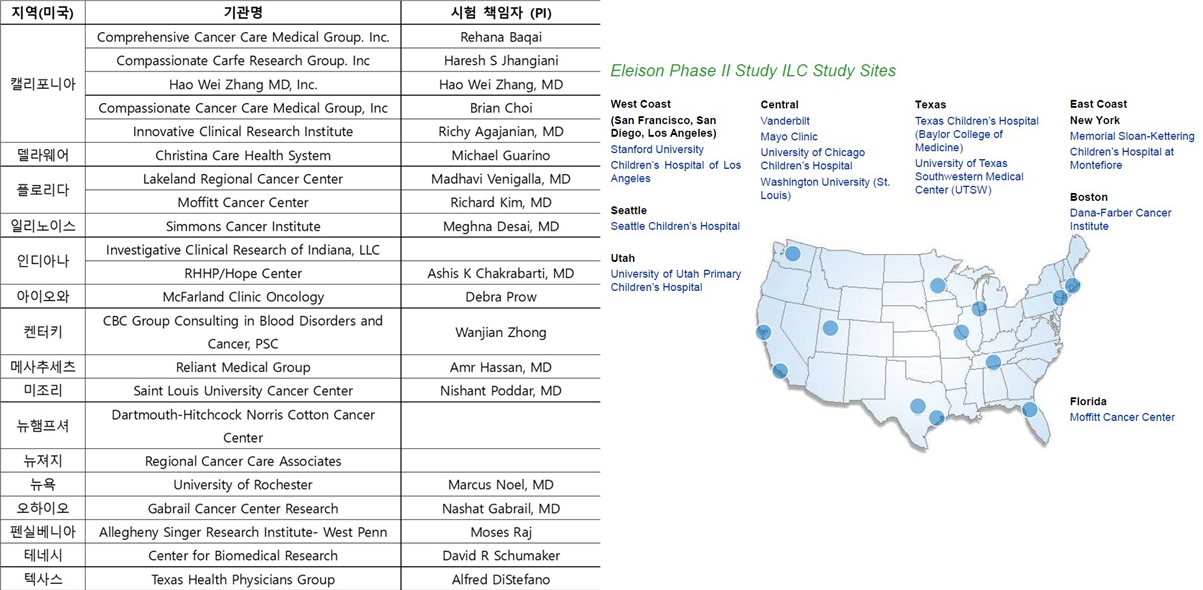
엘리슨은 미국 내 16개 지역의 22개 임상 시험기관에서 480명 환자를 대상으로 글루포스파미드 임상 3상을 진행했다. 다만 최근 코로나19 영향으로 인적 교류가 중단돼 임상이 지연됐다.
비디아이 관계자는 "글루포스파미드 구체적 임상 효능 데이터는 표준 규제 요건에 따라 접근할 수 없지만 안전 데이터는 정기적으로 통보받고 있다"며 "현재까지 새로운 안전 문제는 발견되지 않았고 임상도 순조롭게 진행되고 있음을 보고받았다"고 말했다. 이어 "내년 하반기 아시아와 유럽 등에 신규 등록도 가능해 글루포스파미드 임상에 속도가 붙을 것"이라고 예상했다.
이와 함께 엘리슨은 흡입식 폐암 치료제 'ILC' 임상 2상과 3상 내용을 추가로 보고했다. 지난해 2월 중국에서 임상 2상이 시작한 데 이어 올해 4월에는 미국 FDA에 임상 2상과 3상 시험계획서를 제출해 최종 승인도 기다리는 중이다. 올해 하반기 승인을 받으면 240명 환자를 대상으로 임상 시험을 진행할 계획이다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 스튜디오산타클로스ENT, 주주권익 보호 '구슬땀'
- 이에이트, AI 시뮬레이션·디지털 트윈 기술 선보여
- MBK, '몸값 2조' 지오영 인수 SPA 체결 임박
- [2024 더벨 글로벌 투자 로드쇼-베트남]한인이 설립한 RCE, 세계 첫 ‘중장비 온라인 중고거래’
- 회계법인 해솔, 부동산 타당성 자문 업무협약
- [2024 더벨 글로벌 투자 로드쇼-베트남]베트남의 지오영 '바이메드'·전기오토바이 '셀렉스' 눈길
- 지아이에스, 코스닥 상장 위한 예비심사신청서 제출
- [꿈틀대는 토큰증권 시장]'업계 표준' 루센트블록, '두자릿수' 레코드 조준
- [Company & IB]조달 '막바지' 롯데그룹, 롯데케미칼에 쏠리는 눈
- '910억 CB 발행' 아스트, 경영 정상화 속도 낸다
신상윤 기자의 다른 기사 보기
-
- [건설리포트]주택 키운 제일건설, '실적·재무' 두토끼 잡았다
- 서희건설, 오너 지배력 강화 '애플이엔씨·자사주' 투트랙
- [건설산업 스몰캡 리포트]우원개발, 부동산 개발업 재시동 '차입 활용' 속도
- 역대급 실적 '엠디엠그룹', 현금성 자산 4000억 웃돈다
- 우원개발, 원가율 부담 속 '재무통' 이사회 합류
- 'NPL 눈독' 스타리츠, 부동산 개발사업 진출
- 대우건설, 주택건축사업본부 수장 '핀셋' 인사
- 유신, 분양 수익 '잭팟'…오너일가 자산 유동화 활용
- 대우건설 이어 피앤씨테크도 무궁화신탁 주주로
- 유신, 오너 2세 전경수 회장 4년만에 대표 복귀






















