글로벌 퇴행성디스크 치료제 선두 경쟁 '지각변동' 메조블라스트 세포치료제 3상 재디자인…유한·엔솔바이오 'SB-01' 추격
최은수 기자공개 2022-05-17 14:11:03
이 기사는 2022년 05월 13일 09:59 thebell 에 표출된 기사입니다.
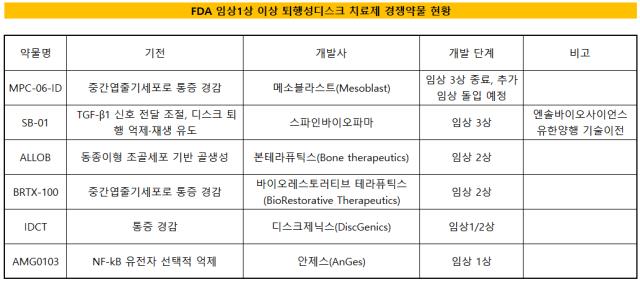
글로벌 퇴행성 디스크 치료제 시장의 경쟁 구도에 변화가 감지되고 있다. 가장 먼저 미국 FDA 임상 3상을 마친 메조블라스트(Mesoblast)의 줄기세포치료제 MPC-06-ID가 추가 임상을 진행하는 사이 경쟁사인 스파인바이오파마가 따라붙었다. 스파인바이오파마의 SB-01은 유한양행으로부터 기술을 이전받은 터라 국내 업계에서도 주목을 받는다.메조블라스트는 올해 1분기 FDA에 제출한 퇴행성 디스크치료제 후보물질 MPC-06-ID 3상 재설계 계획을 승인받았다. FDA 측에서 작년 말 관련 임상 3상 최종 결과를 검토한 뒤 약물 효과가 위약 대비 차이가 없거나 오히려 좋지 않았던 점을 지적한 데 따른 후속 조치다. MPC-06-ID는 중간엽줄기세포로 통증을 완화하는 기전이다.
메조블라스트가 임상 3상을 다시 진행하면 추적관찰 기간을 고려했을 때 2년 이상이 추가로 소요될 전망이다. 메조블라스트가 추가 임상의 1차 평가변수를 12개월 후 통증 감소 여부로 잡은 영향이다. 더불어 기존 임상 3상 참여 환자 중 20% 이상을 추가 임상에 포함시켜 치료 유효성과 통증 감소 여부를 입증할 계획이다.
업계 관계자는 "세포치료제의 경우 기전을 밝히는 것이 어렵고 환자마다 치료 반응이 다양하게 나타나 최근 미국이나 유럽에선 인·허가 사례가 줄어들고 있다"며 "더불어 기존 사용하는 약물도 금지하는 사례도 나타나고 있어 추가 임상을 진행한다 해도 상황을 낙관하기는 쉽지 않다"고 말했다.
메조블라스트가 임상 3상 막바지 단계에 다시 돌입한 가운데 직면한 사이 경쟁사 미국 스파인바이오파마도 올해 4월 SB-01의 임상 3상 IND를 승인받았다. 이에 따라 SB-01은 MPC-06-ID와 임상 진행 단계에서 어깨를 나란히 한 모습이다. 기존 SB-01와 MPC-06-ID와의 R&D 격차는 2년 이상 벌어져 있었다.
스파인바이오파마는 30곳의 의료기관에서 총 400명의 환자를 모집하며 올해 6월엔 임상 3상 첫 약물 투약에 나설 예정이다. 2024년 상반기엔 임상 결과를 확보할 것으로 전망된다.
스파인바이오파마는 국내 바이오벤처 엔솔바이오사이언스와 유한양행으로부터 기술을 이전받아 임상을 진행 중이다. SB-01은 P2K는 체내 TGF-β1에 작용해 신호전달 경로를 조절한다. 통증을 제어하고 디스크 퇴행 진행 방지 및 재생을 유도하는 기전이다.
엔솔바이오 관계자는 "SB-01은 퇴행성 디스크 치료제 퍼스트 인 클래스이자 연골 재생까지 기대할 수 있는 치료제로 개발 중"이라며 "계열 내 최초이자 근본 치료제 지위를 확보하고자 임상 상황과 경쟁 업체의 변화를 예의주시하고 있다"고 말했다.
한편 전 세계 퇴행성 디스크 치료제 시장 규모는 2021년 말 기준 5조원에 달한다. 다만 아직 유효 치료제가 나오지 않아 환자들은 인공 디스크 삽입이나 통증 완화로 치료를 대체하고 있다. 현재까지 FDA 임상 1상 이상 R&D를 수행하는 업체는 전 세계 6곳이다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- 율호,정부 핵심광물 공급망 확대 지원 선정
- 김연수 한컴 대표, '탁월한 선구안' AI 빅테크 이끈다
- CBI 관계사 지비이노베이션, 쌍전광산 장비설비 구축
- [간판펀드 열전]메가펀드 옛 영광 한투네비게이터 '리부트'
- 오가노이드사이언스, 기평 신청…사업성 입증 '관건'
- '개인안전장비 1위' 한컴라이프케어, 새 주인 찾는다
- [HD현대마린솔루션 IPO]고밸류 vs 저밸류…'피어그룹' 훌쩍 넘은 성장 여력
- [Company & IB]글로벌 신용평가 받은 롯데렌탈…'동향' 살피는 IB
- 대동, 농업 챗GPT 서비스 'AI대동이' 오픈
- [카드사 해외사업 점검]우리카드, '악전고투' 미얀마…인니 성장으로 보완
최은수 기자의 다른 기사 보기
-
- [1세대 시퀀싱 강자 마크로젠 분석]주주에 기대지 않는 R&D, 900억 부동산 안전판 역할
- [thebell note]유노비아의 길, 1미터의 눈물
- [1세대 시퀀싱 강자 마크로젠 분석]인체부터 미생물 유전체까지, 본질은 '프리시전 시대'
- 보령바이오파마, 스핀오프 자회사 '비피진' 흡수
- [1세대 시퀀싱 강자 마크로젠 분석]경험서 배운 교훈, '몸BTI' 젠톡…대기업 겁나지 않다
- [비상장 제약바이오 펀딩 리뷰]혹한기 지나 회복국면, A 라운드 초기기업 쏠림 현상
- [1세대 시퀀싱 강자 마크로젠 분석]27년 NGS 개척 역량, 성장한계 B2B 벽 깨고 B2C 변신
- [비상장 제약바이오 펀딩 리뷰]거래액 3800억, 펀딩 회복 주도는 신약아닌 '헬스케어'
- [돌아온 임종윤 넥스트 한미약품]5400억 차입, 취약한 지배구조…묘수는 결국 '백기사'
- 제테마, 국내 데이터로 중국 2상 건너뛰고 '3상부터'























