크리스탈, 야심작 '아셀렉스' 마케팅 문구 논란 '비열등성 임상' 쎄레브렉스 유인물에 '개선' 등 용어 사용
이 기사는 2016년 04월 19일 14:57 thebell 에 표출된 기사입니다.
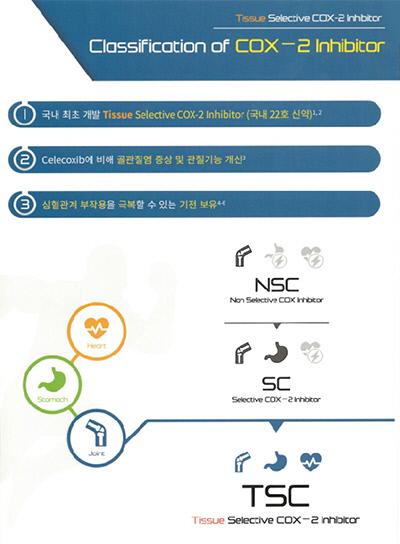
크리스탈지노믹스의 야심작인 국산 22호 신약 소염진통제 '아셀렉스(폴마콕시브)'가 과장 마케팅 논란에 휩싸였다. COX-2 억제제 아셀렉스가 판촉 브로셔(의사 유인물) 등에 같은 계열 '쎄레브렉스(쎄레콕시브)보다 개선된 약제'라는 표현을 쓰고 있기 때문이다.
아셀렉스는 비열등성 임상으로 허가를 받았다. 개선 등 우월함을 입증할 수 없는 연구 디자인이다.
|
시중에 배포된 아셀렉스 유인물에는 '쎄레콕시브에 비해 골관절염 증상 및 관절기능 개선'이라는 문구가 삽입돼 있다. 관련 임상 결과에 따르면 아셀렉스는 신체기능 평가 항목에서 쎄레브렉스에 대비 통계적 유의성을 확보했다. 단 이는 연구 전체 기간(6주=Primary efficacy endpiont)이 아닌 3주차 시점의 결과물이다.
골관절염 통증 증상 평가(WOMAC) 역시 논란의 소지가 있다. 마찬가지로 3주차에 관찰됐기 때문이다. 임상은 6주를 보게 설계됐다.
크리스탈지노믹스 관계자는 "아셀렉스 3상 연구는 6주 동안 쎄레브렉스와 비열등성을 확인하는 목적으로 디자인되었으나 비열등성이 확인된 다음에는 우월성도 확인할 수 있도록 설계됐다. 그 결과 3주차에 일부 항목에서 쎄레브렉스 대비 개선된 효과를 보였다"고 설명했다.
'심혈관계 부작용을 극복할 수 있는 기전'이라는 문구도 나온다. 식약처는 아셀렉스에 대해 COX-2 저해제 약물에서 이미 알려진 바와 같이 심혈관계 이상반응 가능성이 있으므로, 허가 사항 관리 및 REMS 도입을 통해 고혈압을 포함한 심혈관계 부작용 위험을 충분히 관리해야 한다고 명시하고 있다.
|
|
정리하면 아셀렉스는 비열등성 임상으로 허가를 받았다. 따라서 '개선' 등의 표현이 적절치 않다는 지적이다.
한 개원의는 "아셀렉스 해당 논문을 자세히 본 적이 없으며, 국내외 게재된 적도 없는 것으로 안다"며 "회사 유인물에 의존할 수밖에 없는 구조인데, 비열등성 임상으로 허가를 받았다면 개선 등을 주장하면 안 된다"고 말했다.
식약처 관계자도 "아셀렉스는 허가 임상을 통해 WOMAC의 통증, 신체 기능, 전반적 상태 등의 항목에서 위약에 비해 우월성을 지니며 쎄레콕시브(200mg)와 유사한 유효성을 보인다"고 평가했다.
한편 조중명 크리스탈지노믹스 회장은 얼마 전 주주총회에서 아셀렉스의 올해 처방액을 목표를 100억 원으로 제시했다. 크리스탈지노믹스의 작년 매출액은 100억 원에 못 미친다.
best clicks
최신뉴스 in 전체기사
-
- 현대건설, '힐스테이트 죽림더프라우드' 분양 중
- [Red & Blue]새내기주 한싹, 무상증자 수혜주 부각
- 아이티센, 일본 IT서비스 시장 공략 '잰걸음'
- 소니드로보틱스, 온디바이스 비전 AI ‘브레인봇’ 공개
- (여자)아이들 '우기’, 초동 55만장 돌파 '하프밀리언셀러'
- [ICTK road to IPO]미국 국방산업 타깃, 사업 확장성 '눈길'
- [Red & Blue]'500% 무증' 스튜디오미르, IP 확보 '성장동력 발굴'
- [코스닥 주총 돋보기]피엔티, 이사회서 드러난 '중국 신사업 의지'
- [thebell note]XR 기술의 사회적 가치
- [Rating Watch]SK하이닉스 글로벌 신용도 상향, 엔비디아에 달렸다?