한미 당뇨치료제 미국 진출 'CVOT' 검증에 달렸다 이르면 올해 심혈관 안전성 3상 시작…미국 허가 필수조건
이석준 기자공개 2018-02-13 08:07:36
이 기사는 2018년 02월 12일 16시07분 thebell에 표출된 기사입니다
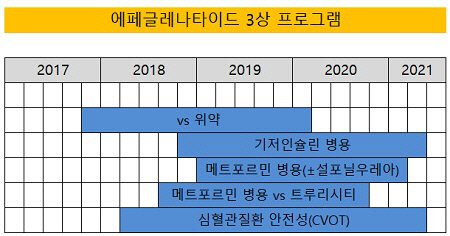
사노피가 한미약품 에페글레나타이드 3상을 5가지로 나눠 동시다발적으로 진행한다. 이중 심혈관 안전성(CVOT, Cardiovascular Outcome Trial) 검증 임상은 에페글레나타이드 시장성을 결정할 핵심 과제로 꼽힌다. CVOT를 입증해야 미국에 진출할 수 있기 때문이다.에페글레나타이드는 GLP-1 기전 지속형 당뇨치료 물질로 한미약품이 2015년 사노피에 5조 원 규모(현재 3조5000억 원 규모로 축소)의 기술수출 당시 포함됐던 신약후보물질 3개 중 하나다.
12일 업계에 따르면 사노피는 최근 2017년 4분기 실적발표에서 기존 1건(댠독요법)에 더해 한미약품 에페글레나타이드 3상 2건(메트포르민 및 기저인슐린 병용)을 올해 추가로 진행한다고 밝혔다. 이를 토대로 2021년 미국 허가 신청 계획도 발표했다.
이로써 현재까지 발표된 에페글레나타이드 임상 디자인은 3개다. 한미약품이 진행하는 5가지 임상 디자인 중 2개는 아직 공개되지 않았다. 남은 2개의 임상 디자인은 3제 복합제(에페글레나타이드+메트포르민±설포닐우레아)와 CVOT 임상이다.
이미 공개된 임상 디자인은 기존 위약이나 기존 당뇨 치료제와 비교를 목적으로 한다. 하지만 업계에선 5가지 임상 중 CVOT 검증을 가장 중요한 임상이라고 보고 있다.
CVOT는 당뇨 치료제의 부작용 중 하나인 심혈관질환 안정성을 다룬다. CVOT는 전세계 1위 의약품 시장인 미국 진출을 위한 의무 임상으로 에페글레나타드 3상 핵심으로 꼽힌다.
미국 식품의약국(FDA)은 2011년 아반디아 퇴출 사건 이후 심혈관 안전성 입증을 의무적으로 요구하고 있다. 당뇨병이 심혈관계 질환 위험요인이기 때문이다. 아반디아는 퇴출 전 전세계 1위 당뇨병치료제였지만 심혈관계 질환 위험성 문제가 대두되며 시장에서 사라졌다.
CVOT 임상은 미국 진출 필수 조건이지만 모든 제약사가 나서는 것은 아니다. 대규모 임상 비용 때문이다. 한미약품이 에페글레나타이드 CVOT를 입증하면 국산 당뇨병치료제 중 최초로 미국에 진출할 확률이 높아진다.
CVOT 임상은 올해 또는 내년초 시작될 것으로 알려졌다. 한미약품이나 사노피는 아직 임상 시기에 대해 확정짓지 않았다.
임상에 돌입하면 파트너 사노피의 개발 노하우는 큰 힘이 될 것으로 보인다. 사노피는 GLP-1 중 최초로 릭수미아에 대해 심혈관 안전성을 입증했다. GLP-1 유사체는 약효 반감기를 기준으로 속효성, 지속성 2가지 계열로 분류된다. 릭수미아는 속효성, 에페글레나타이드는 지속성이다.
한편 에페글레나타이드 3상은 사노피가 주도하며 임상 금액의 25%(최대 부담액 약 1800억 원)는 한미약품이 부담한다.
|
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- [김화진칼럼]영국 RBS
- '환경 변화 고려' CJ제일제당, 그린바이오사업 계속 키운다
- [DN솔루션즈 IPO]고심끝 상장 철회…비우호적 시장 환경에 '결단'
- [i-point]신테카바이오, ‘2025 글로벌 IP 스타기업’ 선정
- [i-point]채비, 서울시 전기버스 충전 인프라 확대 사업자 선정
- [영상/Red & Blue]현대엘리베이터 '주주환원, 리포트, 실적' 삼박자
- 기지개 켜는 인성정보의 '헬스케어'
- [i-point]인텔리안테크, 정부 저궤도 위성통신망 구축 '핵심'
- [NHN 리빌딩]'아픈 손가락' 콘텐츠, 더디지만 잠재력 확신
- [영상]‘메타가 탐낸’ 퓨리오사AI의 백준호 대표에게 들었다…회사의 향후 계획은