대웅제약 나보타, FDA 허가 무슨 단계? 공장 설비 인증 받았지만 품목 보완 지적…내년으로 최종 인증 지연될 듯
강인효 기자공개 2018-05-18 08:15:29
이 기사는 2018년 05월 17일 17시05분 thebell에 표출된 기사입니다
대웅제약이 보툴리눔 톡신(보톡스) 제제 '나보타(전문의약품)'의 미국 식품의약국(FDA) 허가를 마지막 관문만 남겨두고 있다. FDA로부터 제조 시설에 대한 승인을 받았지만 품목 허가에 대해 보완 요청이 제기됐다. 최종 문턱에서 주춤한 모양새다.이번 소식이 전해지자 17일 대웅제약 주가는 7.21%하락한 18만6500원에 거래를 마쳤다. 대웅제약은 FDA 이슈가 발생했을 때마다 주가가 급락하는 패턴을 보였다. 올해 1월 24일 Form 483 수령 사실이 공개됐을 때 대웅제약 주가는 전거래일 대비 11.20% 하락하기도 했다.
하지만 대웅제약의 나보타 미국 허가는 다소 지연되더라도 성사될 가능성이 높다. 업계에선 내년 1분기엔 품목 허가가 가능할 것이라고 예상하고 있다.
|
◇대웅제약 FDA 최종 보완요구 공문 접수
대웅제약은 지난 15일(현지시각) 미국 FDA로부터 나보타 제품 허가와 관련한 '최종 보완요구 공문(Complete Response Letter·CRL)'을 미국 파트너사인 에볼루스가 접수했다고 밝혔다.
의약품 허가 신청 후 문제가 발견됐을 때 전달되는 문서인 CRL은 2개로 구분되는데, 지적사항이 해결되면 'Class 1(라벨링, 안전성 업데이트 등에 해당)'인 경우에는 허가 재신청 후 2개월, 'Class 2(실사 후 허가 재신청해야 하는 경우)'는 6개월 이내에 제품 허가 승인을 받게 된다.
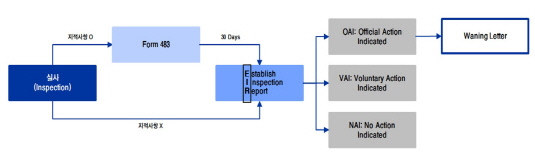
의약품 허가를 받기 위해 앞서 진행되는 FDA 실사는 '사전실사(Pre Approval Inspection)'와 '사후실사(Post Approval Inspection)'로 구분된다. 사전실사는 의약품이 시장에 진출하기 위한 마지막 승인단계인 BLA(Biologics License Application·'바이오의약품' 품목허가 신청), NDA(New Drug Application·'신약' 품목허가 신청), ANDA(Abbreviated New Drug Application·'약식 신약' 품목허가 신청) 후에 진행된다. 상업 생산의 준비, 허가 신청의 정확성, QC(품질관리) 및 QA(품질보증) 데이터를 중점적으로 체크한다.
사후실사의 경우 시장에 출시된 제품에 대해 실시하며 'Surveillance(정기실사)'와 'For-cause(특별실사)'로 구분된다. Surveillance는 정기실사 및 개선사항 요구 후 실시하는 '재실사'이며, For-cause는 신고 등의 특별한 이슈가 생겼을 시 실시하는 '비정기적 실사'를 의미한다.
신재훈 이베스트투자증권 제약·바이오 담당 애널리스트는 "FDA의 실사는 실사 일정 및 장소(Site)를 통보하는 문서인 'Form 482'가 해당 기업에 전달되면서 시작된다"며 "실사담당관(Inspector)은 기존에 작성된 'EIR(Establish Inspection Report)', 'Form 483', Warning Letter(경고편지), 지적사항에 대한 후속조치 문서, 회사의 업력, 소비자 불만 등을 사전에 점검 및 숙지하고 실사에 임한다"고 설명했다.
EIR은 실사보고서로 실사내용과 실사등급(NAI, VAI, OAI)이 기재돼 있으며, 실사 완료 후 30일 안으로 작성된다. Form 483은 실사 후 보완을 요구하는 문서로 실사 마지막날 발부된다. Warning Letter는 실사과정에서 지적사항이 생겨 Form 483을 수령한 업체 중 실사등급이 OAI(Official Action Indicated·부적격 등급)를 받으면 발부된다. NAI(No Action Indicated)와 VAI(Voluntary Action Indicated)는 적격 등급에 해당한다.
|
대웅제약은 나보타의 미국 공략을 위한 준비를 차근차근 해왔다. 대웅제약은 나보타의 FDA 허가를 염두해두고 경기 화성시 향남제약단지에 위치한 나보타 제2공장을 'cGMP' 수준으로 지었다. cGMP는 FDA가 인정하는 우수 의약품 제조·품질 관리 기준을 말한다. 나보타 제2공장은 작년 10월 완공됐고, 다음 달인 11월 8일부터 17일까지 FDA 실사가 진행됐다.
대웅제약이 실사담당관으로부터 Form 483을 받았다는 사실은 올해 1월 22일 FDA 홈페이지를 통해 공개됐다. 나보타 제2공장 실사 결과 보완해야 할 부분이 있었다는 의미다. FDA는 무엇보다 대웅제약의 나보타 공장이 무균 제조 환경을 갖추지 못해 무균 시설에 결함이 있다고 밝혔다. 오염이나 혼합을 방지하기 위한 별도의 구역이나 제어 시스템이 필요한데 이러한 부분이 없었다고 지적했다. 또 무균과 멸균 공정 전체를 검증할 수 있도록 적절한 서면 작성과 공정 관리 절차를 수립해야 한다고도 했다.
대웅제약 관계자는 당시 "Form 483은 GMP(우수 의약품 제조·품질 관리 기준)에 대한 '위반사항(Violation)'을 지적한 것이 아니라 '관찰사항(Observation)'을 나열한 것"이라며 "제조공정과 관련한 위반사항이 있는 것은 아니다"고 해명했다.
대웅제약은 FDA가 Form 483을 통해 보완을 요청한 공장 내 구역 문제를 모두 해결하고 4개월 만인 지난 15일 나보타 제2공장의 cGMP 인증을 받게 됐다. 박성수 대웅제약 나보타 사업본부장은 "나보타 공장의 FDA 승인은 우리가 목표로 하는 본격적인 글로벌 사업 성공을 위한 중요한 첫 발걸음"이라며 "이를 기반으로 유럽, 캐나다, 호주 등 전세계 주요 국가 규제기관의 승인도 순차적으로 완료할 예정"이라고 밝혔다.
◇품목 허가 승인 지연…마이너한 이슈일 듯
대웅제약이 이번에 지적을 받은 것은 품목 허가에 대한 최종 자료 보완이다. FDA는 나보타의 BLA에 대한 검토를 완료하고, 허가 관련 자료 보완을 요구하는 CRL을 대웅제약의 미국 파트너사인 에볼루스에게 통지했다.
신재훈 애널리스트는 "에볼루스는 컨퍼런스콜에서 '나보타에 대한 CRL이 CMC(Chemistry, Manufacturing and Control) 이슈로 발부됐으며, 이 문제로 FDA와 지속적으로 논의했지만 전문의약품 허가신청자 비용부담법(PDUFA)에 따른 목표 시점인 5월 15일까지 이 문제를 해결하지 못했다'고 언급했다"고 밝혔다.
이어 "에볼루스는 나보타에 대한 재심사 청구까지 90일이 소요되고, 이후 14일 동안 진행되는 FDA의 리뷰에서 Class 2에 해당할 것으로 예상한 만큼 재심사 청구 이후 6개월 뒤에 나보타가 최종 승인을 받을 것으로 내다봤다"고 덧붙였다.
이렇게 되면 나보타는 해를 넘겨 내년 1분기에 미국에서 최종 허가 승인을 받을 것으로 예상된다.
구완성 NH투자증권 제약·바이오 담당 애널리스트는 "나보타는 이미 임상을 통해 안전성과 유효성을 입증했을 뿐만 아니라 생산설비 등 주요 이슈를 해결한 상황에서 이번 CRL 통지 사유는 CMC 자료 중에서도 마이너한 이슈로 추정된다"며 "향후 보완자료가 다시 재출된 이후 FDA가 CRL이 Class 1인지 Class 2인지 판단할 예정"이라고 설명했다.
그는 또 "class 1인 경우 올해 8~9월, class 2인 경우에는 올해 12월~내년 1월에 나보타가 미국 허가를 받을 것으로 예상한다"고 덧붙였다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- '승자' SK하이닉스의 책임
- [AACR 2025]제이인츠의 4세대 EGFR 신약 전략 '병용', 근거 마련했다
- [Company Watch]'압도적' 크래프톤, 현금성자산 '4조' 찍었다
- LX세미콘, 5년 투자 신사업 '방열기판' 빛본다
- [thebell interview]김경진의 삼양 바이오 청사진 "DDS 기반 CDMO·신약"
- [Company Watch]'1분기 선방' 대한전선, 해저케이블 본격 시동
- [IR Briefing]삼성전자, '자사주 또 소각' 주가반등 사활
- [DN솔루션즈 IPO]철회 배경에 '과한 밸류에이션·구주매출' 영향 컸나
- KT클라우드 "소버린 AI? 데이터 주도권이 핵심"
- [롯데글로벌로지스 IPO]상장 관건 밴드내 수요 집결…'하방압력' 이겨낼까