[바이오살롱 Brief]헬릭스미스, 화이자식 임상으로 리리카 잡는다3-1상과 3-1B상 방식 유사하지만 세부사항 달라…CRO 컨트롤 책임은 있어
조영갑 기자공개 2019-10-14 08:11:57
[편집자주]
대전, 판교, 오송, 송도 등 제약바이오 클러스터를 중심으로 혁신신약살롱이 한창이다. 살롱은 신약개발과 관련된 다양한 주체들의 '아고라'로 기능하고 있다. 다양한 아이디어가 교환되고, 실제로 현실화되기도 한다. 더벨은 살롱에서 논의되는 다양한 담론에 귀기울여 본다.
이 기사는 2019년 10월 11일 08시20분 thebell에 표출된 기사입니다
헬릭스미스가 당뇨병성 신경병증(DPNP) 유전자치료제 ‘엔젠시스(VM202-DPN)'의 두 번째 3상 결과(3-1B) 발표 이후 자신감을 되찾은 모양새다. 3-1B가 이전의 3-1의 결과를 뒤집고 엔젠시스의 안전성, 유효성을 모두 충족함에 따라 향후 추가로 진행될 후속 임상3상(3-2)은 이 모델을 준거로 진행될 전망이다.지난 10일 인천 송도에서 진행된 송도 혁신신약살롱에서 연사로 초대된 유승신 헬릭스미스 연구소장은 "(이번 3-1B로 인해)리리카처럼 소규모 실험군으로 잘게 쪼개 임상을 진행하는 방식으로 품목허가를 앞당길 수 있다는 자신감을 얻었다"고 밝혔다.
헬릭스미스가 비교 대상으로 꼽은 화이자의 '리리카'와 '뉴런틴'은 DPNP 시장의 90%를 장악하고 있는 경쟁제품이다.
헬릭스미스는 지난 9월 23일 엔젠시스의 임상 3상(3-1)을 발표한 이후 2주 만에 별도의 임상 3상(3-1B) 결과를 발표한 바 있다. 자본시장 일각에서는 같은 약물의 top-line 결과가 2주 간격으로 판이하게 나오자 "혼란스럽다"는 반응을 보이기도 했다. 헬릭스미스 측은 이 두 개의 임상은 독립적인 NCT(일종의 시리얼 넘버)를 가진 별도의 임상이라고 설명했다.
사실상 2개의 임상(3-1, 3-1B)은 한 뿌리에서 나온 두 갈래의 줄기에 비유할 수 있다. 원리와 방식은 유사하지만, 세부사항은 다른 별개의 임상이다. 3-1은 NCT가 02427464이고, 3-1B는 04055090다. 한 뿌리에서 출발한 임상이 쪼개진 이유는 ‘장기 데이터'의 필요성 때문이라는 게 헬릭스미스의 설명이다.
애초 9개월(Day270)짜리 500명 규모의 임상(3-1)을 진행하다가 12개월(Day360)장기추적 데이터가 필요하다는 전문가의 권유에 따라 2018년 12월 FDA의 승인을 받아 별도의 임상(3-1B)를 진행하게 됐다. 3-1의 피험자 400명 중 270일이 지나지 않은 101여 명을 다시 추려 3개월을 더 추적 조사한 셈이다. 위약군은 36%, 투약군은 64% 비율이었다.
3-1에서 위약과 투여군의 혼용이 발견되면서 통증 감소의 유효성을 확인하지 못했지만, 3-1B에서는 명확한 안전성, 유효성 완화 지표가 도출됐다. 특히 통증감소 유효성 지표에서는 위약(Placebo)투여군 대비 6,9,12개월 델타값이 1.1/0.9/0.9로 나왔다. 델타값이 클수록 대비 약효가 크다는 의미다. 더불어 경쟁약물(리리카, 뉴런틴) 대비 델타값 역시 1.3/1.2/1.5로 우수하게 나와 경쟁력을 입증했다는 게 헬릭스미스의 설명이다.
리리카의 경우 실험군을 100~150명 단위로 잘게 쪼개 약 5차례 이상의 임상을 해 결국 품목허가신청(BLA)을 획득한 바 있다. 유 소장 역시 "리리카 방식과 유사하게 소규모 실험군으로 3-1B에서 안전성, 유효성 지표를 확인했기 때문에 향후 진행될 후기 임상(3-2)은 이런 방식으로 소규모 운영할 계획"이라고 밝혔다. 김선영 대표는 이를 수행할 현금성 자산이 2600억원 정도 확보돼 있다고 밝힌 바 있다.
한 가지 의문점은 결과가 중간에 뒤틀린 3-1과 3-1B 사이에 존재하는 '변곡점'이다. 유 소장은 CRO(임상수탁기관)를 원인으로 꼽았다. 잘 알려진 대로 3-1상에서 위약군과 엔젠시스 투약군의 데이터가 뒤틀리면서 헬릭스미스 측은 플라시보와 엔젠시스 약물의 혼용을 원인으로 지목하고, 현재 진상을 조사하고 있다. 하지만 2주 뒤 발표된 3-1B 상에서는 이런 뒤틀림이 없었다.
유 소장은 "임상 2상을 수행한 CRO를 계속 쓰면서 임상 3상(3-1)을 진행했는데, 진행을 하는 도중에 (해당 CRO가)3상을 진행할 능력이 안 된다는 회사의 판단에 따라 교체하고, 3-1B 부터는 완전히 다른 CRO에게 임상을 맡겼다"고 밝혔다. 3-1상이 발표되고 데이터 오류로 추정되는 부분이 초기에 집중돼 있는 건 이 때문이라는 게 유 소장의 부연이다.
이어 "임상 처음 시작했을 때 유전자치료제에 익숙한 CRO가 없어 개념을 이해시키는 자체가 힘들었다"면서 "1상부터 백지 상태에서 회사에서 교육시키면서 임상 관리를 하게 됐고, 그 이후 관련 전문가를 고용하게 된 것은 근 2~3년 밖에 되지 않는다"고 말했다. 하지만 유 소장은 "결국 CRO를 컨트를하는 모든 책임은 스폰서(헬릭스미스)에게 있는데 우리도 이번에 배웠다"고 덧붙였다.
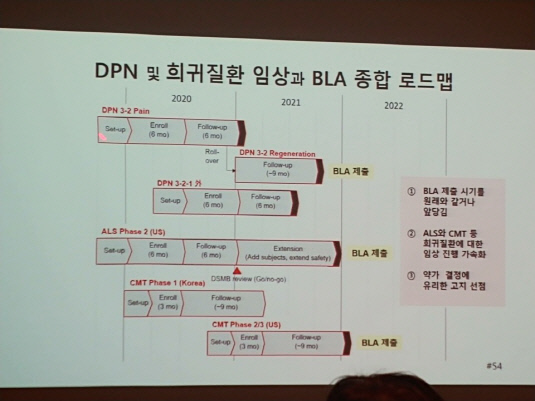
헬릭스미스는 이른바 리리카 방식으로 2021년까지 엔젠시스 3-2상(통증 및 신경재생)을 완료하고 BLA를 제출하거나 더 앞당긴다는 계획이다. 더불어 예고한대로 근위축성 측삭경화증(ALS), 샤르코-마리-투스 병(CMT) 등의 sub 파이프라인 역시 2021년 말 2022년 초 BLA 제출이 목표라고 밝혔다.
|
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [Market Watch]DN솔루션즈 이어 롯데글로벌까지, 대형 IPO '휘청'
- [롯데글로벌로지스 IPO]흥행 실패 우려, 결국 상장 철회로 귀결
- [AACR 2025]제이인츠 'JIN-001', 독성 최소화한 '저농도' 효능 입증
- [Financial Index/SK그룹]주가상승률 50% 상회, SK스퀘어 'TSR' 그룹내 최고
- 금호타이어, 분기 '최대 매출'…영업이익은 '주춤'
- 유지한 SKC CFO "트럼프 관세, 위기보다 기회"
- [i-point]신테카바이오, 'K-BioX 글로벌 SUMMIT 6' 참여
- 간추려진 대명소노그룹 선택지, '티웨이'에 집중
- [감액배당 리포트]제주항공, 신속한 885억 감액…배당은 못했다
- [중간지주 배당수익 분석]세아베스틸지주, 배당수익 3배 급증...분할회사도 첫 기여