[국내 CAR-T 치료제 기업 동향]셀랩메드, 교모세포종 넘어 고형암 암종 확대 목표②고려대 자체 GMP 시설 구축, 임상시료 직접 생산
홍숙 기자공개 2022-01-05 07:20:23
[편집자주]
킴리아, 예스카타, 브레얀지 등 글로벌 제약회사에서 품목허가를 받은 CAR-T 치료제 품목이 5종이다. 국내 기업들도 속속 다양한 차별화 전략으로 CAR-T 치료제 개발에 나서고 있다. 더벨은 국내에서 CAR-T 치료제 연구에 매진하고 있는 주요 기업들의 기술 및 생산 차별화 전략을 들어본다.
이 기사는 2022년 01월 04일 11:37 thebell 에 표출된 기사입니다.
최근 CAR-T 치료제의 고형암 개발은 활발히 이뤄지고 있다. 셀랩메드 역시 글로벌 연구동향에 맞춰 교모세포종 뿐만 아니라 발병률이 높은 폐암 등 다양한 고형암 확장 전략 계획도 있다고 밝혔다. 다양한 암종 확대와 함께 기존 면역항암제 병용 연구도 속도를 낸다는 계획이다.◇GBM 넘어 폐암과 유방암에도 도전할 것
IL13Rα2는 GBM에만 발현되는 항원으로 알려졌다. 최근엔 GBM과 함께 일부 폐암, 삼중음성유방암(TMBC) 세포에서도 항원이 과발현된다는 연구결과가 발표됐다. 이런 연구에 따라 셀랩메드도 1상을 통해 안전성을 입증하면 적응증 확대로 임상 2상을 펼친다는 계획이다.
그는 "자체적으로 암 환자 조직을 확보해 전임상 실험을 한 결과, GBM 외에도 폐암과 유방암에서도 적용이 가능하다는 기초 연구 결과를 확인했다"며 "GBM으로 임상 1상이 진입한 뒤, 빠른 속도로 암종 확대 전략을 펼칠 것"이라고 밝혔다.
GBM은 희귀암종으로 분류된다. 때문에 임상 2상 데이터만으로 조건부허가를 받을 수 있다. 회사는 최대한 빠르게 GBM에 대한 품목허가를 받는다는 전략이다. 이후 이미 확보된 안전성 데이터와 함께 다른 암종으로 확대한다는 계획이다.
그는 "GBM 조건부허가를 획득하면 다양한 치료제와 병용을 통한 연구를 할 것"이라며 "또한 빠른 암종 확대를 위해 현재도 GBM 외에 암종에서도 비임상 데이터를 확보하는 중"이라고 설명했다.
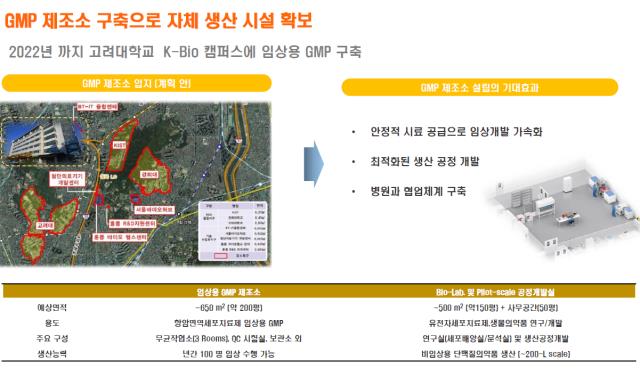
◇GMP 시설 확보 통해 안정적인 임상 기반 다질 것
셀랩메드는 임상 1상은 위탁생산기관(CMO)에 맡긴다. 하지만 임상 2상부터는 자체 GMP 생산시설을 확보한다는 계획이다. 내년까지 고려대학교 메디사이언스파크에 임상용 GMP 시설 구축과 함께 본사도 이전한다.
그는 "임상 1상을 준비하다 보니, 환자의 혈액 채취부터 병원을 거쳐야 하고 여기에 CMO에 위탁제조, 생산까지 통제하는 것이 쉽지만은 않은 작업이었다"며 "고형암은 혈액암보다 표준화된 공정이 없어 공정 자체체가 기술력"이라고 설명했다.
즉, 고형암 CAR-T 치료제는 공정 기술도 회사의 노하우이므로 외부 기관에서 쉽게 공개하기 어렵다는 설명이다.
그는 "고려대학교에 임상용 GMP 시설을 구축해 자체 생산시스템을 공고히 할 것"이라며 "고대 안암병원 등과 긴밀한 협업을 통해 CLM-103을 비롯한 후속 CAR-T 파이프라인들의 개발을 가속화 해 나갈 계획"이라고 말했다.
한편, 셀랩메드는 코오롱인베스트먼트, 우신벤처투자 등 투자자로부터 230억 원 규모의 투자를 받아 시리즈B 투자유치를 지난해 11월 마무리했다. 2019년 셀랩메드는 105억 원 규모의 시리즈A 투자를 유치한 바 있다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- 우리금융 "롯데손보 M&A, 과도한 가격 부담 안한다"
- 신한캐피탈, 지속성장 포트폴리오 리밸런싱 체계 강화
- 하나금융, ELS 악재에도 실적 선방…확고한 수익 기반
- 하나금융, 자본비율 하락에도 주주환원 강화 의지
- 국민연금, '역대 최대 1.5조' 출자사업 닻 올렸다
- [도전 직면한 하이브 멀티레이블]하이브, 강한 자율성 보장 '양날의 검' 됐나
- [퍼포먼스&스톡]꺾여버린 기세에…포스코홀딩스, '자사주 소각' 카드 재소환
- [퍼포먼스&스톡]LG엔솔 예견된 실적·주가 하락, 비용 절감 '집중'
- [퍼포먼스&스톡]포스코인터, 컨센서스 웃돌았지만 주가는 '주춤'
- 신한금융, ‘리딩금융’ 재탈환에 주주환원 강화 자신감




















