[제약바이오 시총분석]'ITP 2상 시간차 공시' 오스코텍, 시총 1000억 증발첫 공시 없던 p밸류 장 시작 전 공개, 투심 악화… 전체 데이터 6월 EHA서 공개
최은수 기자공개 2023-02-27 12:27:43
[편집자주]
시가총액이 반드시 기업가치를 대변하는 건 아니다. 신약개발에 도전하는 바이오업체일수록 더욱 그렇다. 하지만 시가총액은 제약바이오산업의 상황을 보여주는 좋은 잣대가 되기도 한다. 임상 결과나 기술이전(라이선스아웃) 등이 빠르게 반영되고 시장 상황도 고스란히 반영되기 때문이다. 코스닥과 코스피에 상장된 제약바이오 회사의 시가총액 추이를 통해 제약바이오 산업 이슈와 자본시장의 흐름을 짚어본다.
이 기사는 2023년 02월 27일 07:54 THE CFO에 표출된 기사입니다.
면역혈소판감소증(Immune thrombocytopenia, ITP) 치료제 세비도플레닙(Cevidoplenib) 미국 2상 톱라인 데이터를 공개한 오스코텍의 주가가 요동쳤다. 23일 받아 든 톱라인을 분석한 결과 당초 계획한 임상 목표치를 충족한 것으로 확인됐지만 통계적 유의성 여부를 가늠하는 p밸류값을 최초 공시에 표기하지 않은 게 발단이 됐다.이튿날 오스코텍은 정정공시를 통해 공개한 p밸류가 유의성 확보를 하지 못했다는 내용을 덧붙였다. 이를 임상 실패로 판단한 투자자들의 실망매물이 쏟아지면서 장 시작 직후 주가는 약 20% 가량 하락했다. 이후 일부 하락세를 회복하긴 했지만 24일 하루 동안 시가총액은 1000억원이 증발했다.
◇23일 첫 공시 후 12시간 만 정정… 갑론을박 낳은 'p밸류'
오스코텍은 지난 23일 밤 늦게 ITP 2상 톱라인 결과를 처음 공시했다. 해당 임상은총 61명의 모집환자에서 '유효성'을 확보하는 목적으로 진행됐다. 세비도플레닙은 경구용 SYK 억제제다. 오스코텍은 이를 류마티스관절염(RA) 치료제로도 개발했다. 해당 임상에서 확보한 안전성 데이터를 토대로 ITP로 적응증을 확대해 밸류업에 나섰다.
세비도플레닙은 RA 치료제 개발을 위한 2021년 임상(2상)에선 유효성 입증에 실패하며 개발 전략 재정비에 들어간 상태다. 다만 당시 모집환자 163명에 투약 결과 심각한 독성은 관찰되지 않아 안전성을 입증했던 만큼 ITP 임상에 이를 준용해 전체 프로토콜을 설계할 수 있었다.
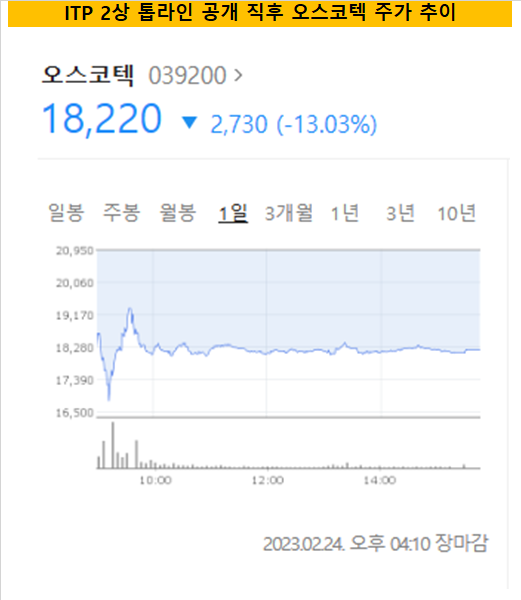
오스코텍은 해당 임상을 수행한 결과 61명의 환자 중 위약군을 제외한 코호트에서 54.2%의 높은 반응률을 확보했다. 이번 임상 톱라인 데이터는 앞서 진행한 류마티스 관절염 1상에서 안전성을 입증한 이후, ITP 2상에서 유효성(Efficiency)도 확보했다는 것이 골자다.
통상 ITP의 1차 치료제로 쓰이는 스테로이드 및 글루코코르티코이드 등은 부작용 및 안전성 문제로 한계가 뚜렷하다. 세비도플레닙은 앞서 RA 임상에서 안전성이 확인됐고 반응률이 기존 치료제 대비 높은 점을 고려하면 전체 임상 결과는 긍정적으로 해석이 가능했다.
다만 오스코텍이 처음 진행한 톱라인 공시에서 통계적 유의성 여부를 확인할 수 있는 p밸류를 알리지 않으면서 시장은 의구심을 갖기 시작했다. 오스코텍은 첫 공시 이후 12시간이 지난 뒤 정정공시를 통해 통계적 유의성을 확보하지 못했다는 p밸류를 알렸고, 투심은 빠르게 흔들리기 시작했다.
사실 이번 임상의 경우 전체 환자 모수도 적은 걸 감안하더라도 p밸류 확보는 임상 성패를 판단하는 중요한 분기점이다. 더불어 세비도플레닙이 앞서 RA 임상에서도 유효성에 확보에 실패했었던 전례가 있던 만큼, 장 초반 패닉 셀이 시작됐다. 23일 7700억원으로 장을 마감했던 오스코텍의 시가총액은 개장 직후 6000억원 대가 무너지기도 했다.
업계 관계자는 "바이오 임상 결과를 모두 해독할 수 없는 시장에선 데이터 가운데 p밸류를 매우 높게 평가하는 경향이 있다"며 "오스코텍이 유의성을 달성하지 못했다는 데이터를 정정공시를 통해 알리면서 시장의 불안감이 커진 측면도 없지 않다"고 말했다.
◇세부 데이터 6월 유럽혈액학회서 공개… 흔들린 투심 잡을까
오스코텍은 24일 두 차례에 걸친 공시 이후 톱라인 데이터 분석 결과 1차평가변수가 임상시험계획을 통해 설정했던 제반 목표에 부합했다고 판단했다. ITP가 워낙 의학적 미충족 요구 (medical unmet needs)가 높은 질환인데 50%가 넘는 반응률을 확보한 것은 추후 상용화 가능성을 높이는 요인이기 때문이다.
특히 160명을 통해 확인한 안전성이 뒷받침되면서 고용량(400mg)으로 갈수록 반응률이 올라가는 점은 주목할 사안이다. 이번 ITP 임상의 일차평가지표는 혈소판 수치 3만/µL 이상 및 기저 시점(베이스라인) 대비 2배 이상 개선으로 정의된 반응률인데, 고용량 투약군의 반응률은 63.6%에 달했다.
해당 임상에서 위약을 투약한 모집군(플라시보)의 반응률은 33%였다. 통상 다른 ITP 경쟁 약물의 위약군 반응률이 2%~4%였던 점을 고려하면 해당 톱라인 데이터는 아웃라이어(Outlier)로 불리는 비신뢰군을 제외하지 않은 가공 전 데이터(Raw data)일 가능성이 크다. 올해 6월 세부 및 전체 데이터를 유럽혈액학회에서 공개할 예정이다.
업계 관계자는 "해당 학회에서 전체 임상 결과가 공개되면 제2의 레이저티닙으로 주목받는 ITP 치료제 임상 성패를 명료하게 가늠할 수 있을 것"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- '배터리 고민' SK, 신용위험 완화 기대요인 '반도체'
- 넷마블, 하이브 지분 2.6% 'PRS'로 미래에셋에 처분
- 인텔리안테크, 산업부 '소부장 으뜸기업' 선정
- [Korean Paper]'7.4조' 조달계획 도로공사, 공모 달러채로 '신호탄'
- [Korean Paper]파운드화 조달 나선 수출입은행, SSA 발행 '포석'
- [Red & Blue]'수소사업 확장' 한선엔지니어링, 부산공장 증설 검토
- 폴라리스오피스, 애플 '맥OS'에 AI 오피스 탑재
- [유증&디테일]상장 반년새 증자나선 퀄리타스, 인력확보 '집중'
- [정육각은 지금]대기업 삼킨 스타트업, '승자의 저주' 극복할까
- 이강수 대표, 지구 끝까지 발로 뛰는 심사역의 정석
최은수 기자의 다른 기사 보기
-
- 닥터노아, 뒤센근위축증 치료제 美 '희귀의약품' 지정
- '유한양행 포트폴리오' 바이오포아, 자금조달 초읽기
- 제넥신, 개발 전략 변경 '법률 비용 리스크'로 번졌다
- 대웅제약의 치료용 보톡스, 2상 1차 지표 충족 못했다
- 'FDA 품목허가 자신감' 휴젤, E타입 톡신 개발 착수
- [thebell interview]박소연 프레스티지바이오파마 회장 "본질은 혁신신약''
- 코로나 공백 메우기 SK바이오사이언스, 실적·신사업 이상무
- 아스트로젠, 자폐스펙트럼 치료제 희귀의약품 지정
- 유동성 확보한 오름테라퓨틱, IR 전담 인력 뽑는다
- 테라펙스, 피노바이오 손잡고 '미지 영역' DAC 정조준






















