일리미스테라퓨틱스, 시리즈 A 200억 완료 박상훈 대표 2021년 창업…프리밸류 450억 인정
임정요 기자공개 2023-04-06 11:05:14
이 기사는 2023년 04월 05일 16시18분 thebell에 표출된 기사입니다
일리미스테라퓨틱스가 200억원 규모 시리즈 A 조달에 성공했다. 최근 바이오 시장이 침체된 와중에도 초기 펀딩 단계에 큰 액수의 투자를 유치하며 눈길을 끌고 있다.업계에 따르면 일리미스테라퓨틱스는 이달 내 총 200억원의 시리즈 A 납입이 완료된다. 이 과정에서 450억원의 프리밸류를 인정받았다. 직전 라운드 대비 밸류 상향도 이뤘다.
이번 시리즈 A에는 우리벤처파트너스(옛 다올인베스트먼트, KTB 네트워크), 아주IB투자, 컴퍼니K파트너스, 데일리파트너스가 후속투자했고 산업은행, 스틱벤처스, 쿼드자산운용, GS벤처스, LSK인베스트먼트, 원익투자파트너스, NH투자증권이 신규투자했다.
◇"'ILM01' 프로그램 후보물질 올해 안에 도출"

일리미스테라퓨틱스는 2021년 시드펀딩으로 12억원, 프리A 펀딩으로 80억원을 투자받았다. 이번 A 라운드 200억원까지 합하면 누적 292억원을 외부 조달했다.
박 대표는 어려운 장 중에도 밸류업 조달에 성공한 부분에 대해서 "초기 투자 단계라 기존 밸류가 낮았기 때문에 가능했던 것 같다"고 말했다.
직전 라운드와 이번 A 라운드 사이에는 인력 구성과 R&D 측면에서 변화가 있었다.
박 대표는 "프리 A는 회사를 설립하자마자 조달해 당시 인력이 10명 이하였는데 현재는 27명으로 늘었다"며 "CMC, R&D, 경영, 사업/전략 쪽으로 전문성있는 인력을 충원했다"고 말했다.
또 "연구개발면에서 플랫폼 기술의 최적화를 이루었고 유전자치료제를 접목해 모달리티의 다양화가 진행되고 있다"며 "아밀로이드베타 표적 'ILM01' 프로그램의 후보물질을 올해 안에 도출할 것"이라고 말했다.
"플랫폼 기술이기 때문에 아밀로이드베타를 포함해 타우단백질, 알파시뉴클레인 쪽 항체를 보유하거나 질환영역에 전문성이 있는 회사들과 파트너십 기반으로 공동 연구개발하는 방향도 활발히 논의하고 있다"고도 말했다.
◇염증 부작용 적은 플랫폼 기술로 승부
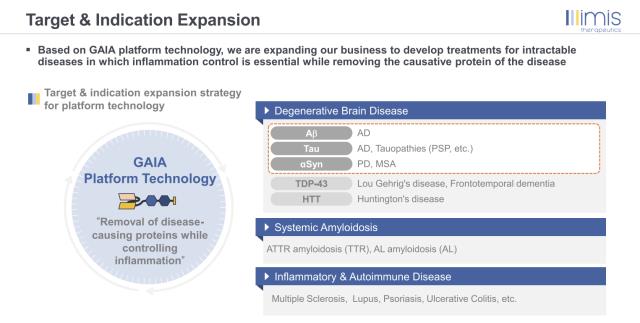
일리미스테라퓨틱스는 자체개발한 플랫폼 기술을 이용해 알츠하이머 등 퇴행성뇌질환 치료제를 연구하고 있다. 'Gas6-매개 항염증성 어댑터'를 줄여 'GAIA'라고 명명한 이 플랫폼 기술은 항체에 Fc수용체 대신 TAM수용체를 붙여 뇌염증없이 아밀로이드 침전물을 없앨 수 있다는 설명이다.
GAIA를 이용하면 기존 FDA 허가받은 치매치료제 아두카누맙(Aducanumab) 보다 뇌염증 부작용이 적다는 사실을 확인했다. 해당 동물실험 개념증명 데이터를 작년 8월 네이쳐메디슨(Nature Medicine)지에 발표했다.
퇴행성뇌질환 치료제 개발사들의 공통된 딜레마는 알츠하이머성 치매의 발병원인이 명확하게 규명되지 않았다는 거다. 지난 100년의 글로벌 연구 결과 과학자들은 뇌내 아밀로이드베타 찌꺼기가 퇴적되면 치매로 이어진다는 가설을 세웠다. 이어 타우단백질의 엉킴이 문제라는 가설도 등장했고 최근에는 APOE4 유전자가 원인으로 탄력을 받고 있다.
원인을 알지 못하는 병에 치료제를 개발하는 것은 쉽지 않은 일이다. 그렇다고 치매 인구가 늘어나는 상황에 신약 연구를 그만둘 수도 없다.
때문에 미국 FDA는 알츠하이머 증상 자체를 개선시키는게 아니라 원인으로 추정되는 '바이오마커'를 없애는 것만으로도 신약허가를 내주는 전례를 보였다. 2021년 6월 허가받은 바이오젠(Biogen)사의 아두카누맙이 처음이었다.
바이오젠은 올 1월 에자이(Eisai)와 공동개발한 레카네맙(Lecanemab)까지 허가를 득했다. 로슈의 간테네루맙(Gantenerumab)이 다음 허가를 득할 것으로 유력하다. 모두 치매 자체를 해결하기 보다는 바이오마커를 해결한다.
한편 기허가받은 약인 아두카누맙과 레카네맙은 정도의 차이는 있지만 둘 다 뇌부종 및 뇌내출혈을 일으키는 'ARIA'라는 부작용이 있다. 일리미스테라퓨틱스의 'ILM01' 프로그램은 아밀로이드베타 침적물을 타겟하되 ARIA 부작용이 덜하다는 내용이다.
회사는 아밀로이드베타 뿐 아니라 타우단백질, 알파시뉴클레인응집체 등 기타 타겟까지 연구개발을 넓혀 파킨슨병, 척수근위축증 등 질병에까지 도전할 계획이다. 나아가 퇴행성뇌질환 외에 다발성경화증, 루푸스신염, 건선, 궤양성대장염 등의 염증성 면역질환까지 확장을 염두에 두고 있다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- 신세계그룹, ‘전략실 재편’ 제이슨황 역할 커지나
- 삼양홀딩스, 삼양바이오팜 '4년만' 다시 분할…신사업 확장 '기대'
- 전력기기 '초호황' 효성중공업, 실적·주가·배당 조건 다 갖췄다
- 폴란드법인 매출 급증…아주스틸·동국씨엠 협력 성과 본격화
- '3수만에' 유증하는 한화에어로, '세가지' 이득
- K배터리 유럽법인 적자전환, 반전카드 'LFP'
- 美 FEOC 겨냥, 포스코퓨처엠 구형흑연 4만톤 양산 목표
- 공격적 투자 세아창원특수강, '핵융합 소재' 주목
- 현대로템, '주주환원' 배당재개로 지수 편입
- [i-point]폴라리스오피스, 국민대와 AI 실무 인재 양성 ‘맞손’























