[클리니컬 리포트]박셀바이오, 2a상 지표 충족 '아바스틴+티쎈트릭' 대항마부작용 없이 ORR 68.75%, 표준치료제 2배…'현재진행 중 무진행생존기간' 주목
최은수 기자공개 2024-05-24 09:04:39
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2024년 05월 23일 14:50 thebell 에 표출된 기사입니다.
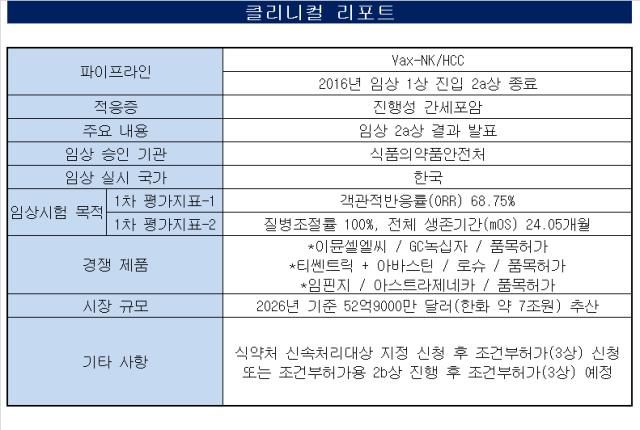
NK세포를 활용해 진행성 간암 치료제를 개발 중인 박셀바이오가 임상 2a상에서 고무적인 결과를 받아들었다. 출시 20년 차 여전히 처방 시장에서 위용을 자랑하는 아바스틴의 대항마로 자리하기에 충분한 '데이터'를 확보한 점이 눈길을 끈다.◇난치암 간암서 최종 60% 후반대 ORR 2a상 '순항'
박셀바이오는 자체 파이프라인 'Vax-NK/HCC와 HAIC(간동맥주입화학요법)' 병용 임상 2a상 결과를 통해 68.75%의 객관적반응률(ORR)과 24.05개월의 전체생존기간 중앙값 그리고 100%의 질병조절률을 기록했다고 공개했다.
해당 임상은 암이 있는 국소 부위에 간동맥주입화학요법(HAIC)으로 치료를 받은 진행성 간암 환자를 대상으로 진행됐다. 앞서 확보한 ORR을 1차 유효성지표(Primary endpoint)로 잡았고 2차 지표(Secondary endpoint)로 질병조절률, 종양 진행까지의 시간, 전체 생존기간 등을 잡았다. 임상이 모든 평가지표를 충족했다는 의미다.
박셀바이오의 Vax-NK/HCC와 HAIC 병용은 1차 치료제 시장을 노린다. 통상 현재까지 처방 가능한 표준치료제의 ORR이 30% 선에 머무는 점을 고려하면 상당한 수치다. 난치암으로 꼽히는 간암은 물론 일반적인 암종 후기 임상에서 60% 후반 ORR을 기록한 사례 자체가 드물다.
ORR만 놓고 보면 적응증과 모달리티는 다르나 유방암에서 82%, 위암 및 폐암 등에서 연이어 60% 후반대를 기록한 ADC 치료제 엔허투(Enhertu)에 버금간다. 체내 NK세포를 활성화시키는 기전인만큼 항암 치료에서 빈번히 발생하는 부작용도 이번 임상에선 나타나지 않았다는 점도 특징이다.
세부적으로 박셀바이오의 치료법 전체생존기간 중앙값은 24.05개월이었다. 두가지의 표준치료법인 소라페닙의 16.9개월 대비 약 7.15개월, 현재 대세로 떠오르는 티쎈트릭과 아바스틴(아테졸리주맙+베바시주맙, ATE+BEV) 22.8개월 대비 1.25개월 연장시켰다. 전체 생존기간만 놓고 보면 박셀바이오의 치료법과 ATE+BEV 간 큰 차이가 없어 보인다.
그러나 ATE+BEV 치료법의 객관적반응률은 30%, 질병조절률은 74% 수준이고 무진행생존기간 8.8개월이다. 박셀바이오 치료법의 무진행생존기간 중앙값은 임상연구자 기준 16.82개월이고 독립검토위원회의 분석값은 아직 중앙값에 도달하지 못해 숫자로 도출되지 않았다. 다만 앞서 임상연구자 분석값 보다 더 긴 수치가 나오는 건 확정됐다. 임상연구자 기준 데이터만 놓고 봐도 ATE+BEV 요법의 2배 수준이다.
◇간암 1차 표준치료 판도 바뀌나 후기 임상+상업화 전략에 눈길
박셀바이오가 추후 임상 및 상업화 전략을 어떻게 잡느냐에 따라 1차 표준치료제 시장 판도가 뒤바뀔 가능성이 존재한다. 2020년 ATE+BEV 요법은 소라페닙(제품명 넥사바)이 독점하던 간암 1차 치료제 자리를 새롭게 차지했다.
현재까지 박셀바이오의 요법은 객관적인 데이터를 통해 ATE+BEV 간세포암 표준치료법보다 여러모로 우수한 치료 효과를 증명했다. 특히 자체면역세포를 활용하는 기전인만큼 항암 치료에서 빈번히 발생하는 부작용도 없었다. 안전성은 치료제가 상용화되는 데 중요한 판단 요소다.
최근 간암 치료 트렌드가 아바스틴이 대표하는 표적항암제에서 면역항암제로 바뀌는 점은 박셀바이오에 긍정적인 요인이다. 앞서 바이엘의 넥사바와 렌비마(렌바티닙)이후론 줄곧 면역항암제가 처방 시장에서 채택돼 왔다.
신생혈관을 표적해 억제하는 아바스틴 역시 면역항암제 티쎈트릭(성분명 아테졸리주맙)과 조합해 인허가 문턱을 넘었다. 이밖에 임핀지(성분명 더발루맙)와 이뮤도(성분명 트레멜리무맙)를 병용으로 하는 치료법도 면역항암요법으로 국내에서 승인을 받았다.
박셀바이오는 이 흐름을 파악해 면역세포치료제로 간암 치료제 개발을 가속화해 왔다. 개발 타임라인을 앞당기기 위해 임상 2a상을 마무리하고 임상 2b상를 조건부허가 품목허가용 임상으로 진입하는 전략도 고려 중이다.
이제중 박셀바이오 대표는"식품의약품안전처 조건부 허가를 위한 신속승인 대상 신청 및 첨단재생법에 따른 첨단재생 치료 허가 등, 사업화에 빠르게 나설 것"이며 "간암에서 유효성을 확인한만큼 적응증을 소세포폐암, 췌장암 등으로 확대할 계획"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- [한미 오너가 분쟁]임주현 "임종윤과 다른 길, 해외투자 유치는 곧 매각"
- [i-point]미래산업, 용인 반도체 클러스터 L-벨트 이전
- [한미 오너가 분쟁]소액주주 만난 임주현, 핵심은 'R&D' "한미정신 지킨다"
- '나형균호' 오하임앤컴퍼니, 사업 다각화 고삐
- [i-point]휴림로봇, 일반공모 유상증자 청약률 196.5% 기록
- [i-point]부스터즈, 네이버 스마트스토어·자사몰 매출 전략 강화
- '탄소제로 대비' 대우건설, 환경 에너지 정조준
- [시큐리티 컴퍼니 리포트] 시큐아이, 빅3급 실적에도 '보안 거리 먼' 임원들 우려
- [i-point]엑스페릭스-퓨리오사AI, UAE 방문 '협력 강화'
- 성장 돌파구 모색 KT스카이라이프, AI·아마스포츠 공략
최은수 기자의 다른 기사 보기
-
- 프레스티지바이오파마, 허셉틴시밀러 'EMA 승인권고'
- LG화학, '캐즘·석화불황' 보릿고개 넘는 비결 '바이오'
- [미지의 시장 '치매' 개화 길목에 서다]세번째 약물 '근본치료제'의 등장, 수십조 시장이 움직인다
- [Policy Radar]달라진 거래소 기조, 바이오텍 상장 심사 속도 빨라졌다
- [클리니컬 리포트]종근당, '10년의 도전' 탈모 '주사형' 차별화로 3상 진입
- 아보메드, 펀딩난에도 150억 시리즈C '멀티클로징' 막바지
- [제약바이오 시총분석]'잠재역량을 현실로' 유틸렉스, 잃었던 투심 회복 시작
- '100억 프리IPO' 레드엔비아, 상장 예심 청구 준비 '막바지'
- 아리바이오, 중국 기술이전 1200억 업프론트 확보 막바지
- [한미 오너가 분쟁]신동국-모녀 3자 주식매매계약, '한양정밀' 가세



















