[마이크로바이옴 신드롬]한계에도 가능성 보여준 '레비요타' 신약 개발 신호탄일까①작년 FDA로부터 품목허가 획득…국내 개발사들 암·자가면역 질환 등 공략
홍숙 기자공개 2023-04-12 13:00:29
[편집자주]
지난해 페링제약의 '레비요타'가 미국 식품의약국(FDA)로부터 품목허가를 획득하며 마이크로바이옴 치료제 개발이 다시금 주목 받았다. 주로 인체 내 미생물을 대상으로 약물 개발이 이뤄져 높은 안전성이 장점이었지만 그만큼 유의미한 효능을 확보하는 데 한계가 있었다. 국내에서는 아직 글로벌 신약이 나오지 않은 마이크로바이옴을 활용해 다양한 질환을 타깃으로 신약개발에 나서고 있다. 주요 제약바이오사의 마이크로바이옴 활용 전략을 살펴보고 신약 모달리티로서의 가능성을 진단해 본다.
이 기사는 2023년 04월 11일 07시42분 thebell에 표출된 기사입니다
지난해 12월 미국 식품의약국(FDA)은 분변이식(FMT) 기반 마이크로바이옴 치료제 레비요타를 품목허가했다. 해당 치료제가 승인을 받으며 업계에서는 마이크로바이옴 신약 시대가 가까워지고 있다고 환영하는 분위기다.또 다른 한편에서는 환자의 부족한 장내 미생물을 주입해 주는 FMT를 단지 정제로 만든 것일 뿐이라는 의견도 있다. 아직 진정한 의미의 마이크로바이옴 신약 개발을 위해선 시간이 더 필요하다는 설명이다.
국내에서는 아직 신약개발 초기 단계에 머물러 있는 마이크로바이옴을 기회로 보는 분위기다. 기업들이 관련 모달리티로 다양한 질환을 공략하는 한편 정부에서도 약 4000억원 규모로 다양한 지원사업을 계획하고 있다.
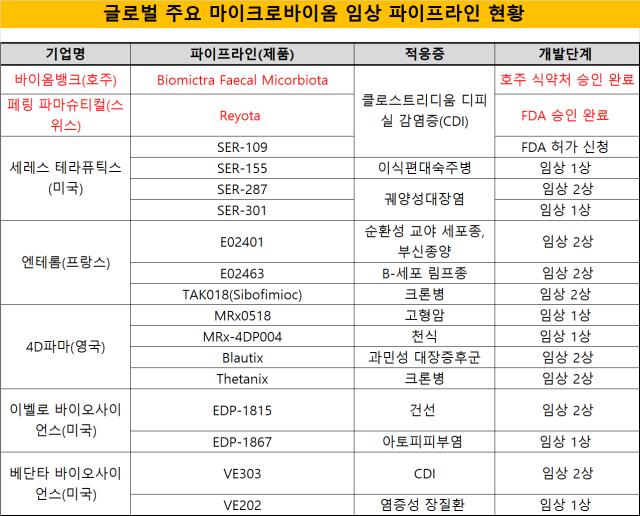
◇'레비요타'의 등장으로 시작된 마이크로바이옴 신약...세레스·4D파마 등 임상 진행
마이크로바이옴은 우리 몸 속에 있는 미생물과 그 유전정보를 통칭하는 의미로 쓰이는 용어다. 유전체 분석(유전자 서열 분석 등)을 비롯한 다양한 오믹스(omics) 분석법이 등장하며 질환을 치료할 수 있는 마이크로바이옴 균주가 규명됐다. 이를 통해 마이크로바이옴이 신약개발에 활용되기 시작했다.
마이크로바이옴은 이미 인간의 몸 속에 오랫동안 공생해 온 균주이기 때문에 안전성 측면에서 다른 의약품 대비 이점을 갖는다. 반면 높은 안전성과는 반대로 기대만큼 약물 효능에서는 유의미한 결과를 얻지 못했다.
특히 작년 레비요타 승인 전까지는 마이크로바이옴 업계는 혹한기를 겪었다. 마이크로바이옴 신약 개발의 대표주자인 핀치 테라퓨틱스, 이벨로 바이오사이언스, 베단타 바이오사이언스 등은 임상에서 통계적 유의성을 달성하지 못하고 인력 감축까지 단행했다.
작년 말 레비요타의 승인으로 마이크로바이옴 업계에 분위기가 반전됐다. 그러나 여전히 진정한 의미의 마이크로바이옴 신약은 등장하지 않았다는 의견도 우세하다.
제약바이오 업계 관계자는 "레비요타는 항생제 치료 후 죽은 장내세균을 대체(replace)해 주는 것으로 진정한 의미의 마이크로바이옴 신약으로 보기는 어렵다"며 "마이크로바이옴의 경우 질환에 대한 명확한 효능을 나타낼 수 있을지는 임상 결과를 좀더 지켜봐야 할 것"이라고 말했다.
레비요타에 이어 세레스 테라퓨틱스가 개발한 CDI 타깃 파이프라인 'SER-109'도 FDA 품목허가를 신청한 상황이다. 이번달 안으로 승인 여부가 결정될 전망이다.
세레스테라퓨틱스 외에도 임상을 진행하고 있는 기업은 장 질환을 타깃으로 마이크로바이옴 신약을 개발 중이다. CDI를 비롯해 염증성장질환, 궤양성대장염을 타깃으로 신약을 개발 중이다. 여기에 4D파마와 이벨로바이오사이언스는 건선, 아토피피부염까지 질환을 확장해 나가고 있다.
업계 관계자는 "장질환 외에 질환으로 마이크로바이옴 신약을 개발하려면 마이크로바이옴 단독으로 임상을 설계할 지 다른 약물과 병용해 효능을 높이는 전략을 펼칠지 임상 디자인 설계가 관건"이며 "후기 임상에서 마이크로바이옴 단독으로 임상을 진행한 경우 효능 데이터가 유의미하지 않은 경우가 종종 있었다"고 말했다.
◇정부, 4000억 규모 마이크로바이옴 신약 중심 지원책 발표...전임상부터 제품화까지
아직 글로벌 시장에서 독점적 위치를 가진 기업이 없는 만큼 정부는 마이크로바이옴 시장을 기회로 보고 있다. 이에 따라 정부는 과학기술정보통신부와 보건복지부 등 6개 부처를 중심으로 2025년부터 '인체질환 극복 마이크로바이옴 기술개발사업(가칭)'을 진행해 관련 산업을 육성한다는 계획이다. 지원 규모는 4000억원 내외다. 현재 사업 진행을 위한 예비타당성조사를 진행 중이다.
정부는 인체 마이크로바이옴 기술개발 사업은 신약 등 산업계를 육성하는 데 초점을 맞춰 사업을 추진한다는 계획이다. 이를 위해 (마이크로바이옴) 뱅크 및 데이터 구축, 전임상 기반 원천기술 개발, 임상 및 제품화 연구 단계로 세분화해 지원책을 마련했다.
복지부와 식품의약품안전처가 신약 개발을 위한 전임상부터 제품화 R&D를 위한 임상 연구를 지원한다. 산자부는 마이크로바이옴 임상 시료를 비롯한 제품을 생산할 수 있는 인프라 구축에 나선다는 전략이다. 이와 함께 마이크로바이옴 신약 개발 지원을 위해 병원을 기반으로 질환군별 마이크로바이옴 데이터 수집에도 적극적으로 나선다는 계획이다.
이광준 질병관리청 과장은 4일 열린 한국바이오협회가 주관한 '마이크로바이옴 산업 세미나'에서 "아직까지는 학계 중심의 기초연구가 많이 이뤄지고 있지만 최근 산업통상자원부를 중심으로 개발 연구를 비롯해 화장품 등을 중심으로 제품화 연구도 많이 이뤄지고 있다"며 "이런 상황에 비춰 정부도 내분비질환 등 치료제 연구를 위한 지원책 마련에도 적극적으로 나서고 있다"고 말했다.
◇제약사·대기업, 투자 통해 진출...바이오텍, 자체 파이프라인으로 다양한 질환 공략
정부와 마찬가지로 국내 기업 역시 마이크로바이옴을 기회로 보고 있다. 특히 마이크로바이옴 중심 바이오텍 외에도 제약사를 비롯해 CJ와 셀트리온 등과 같은 기업에서도 투자와 자체 파이프라인 확보를 통해 마이크로바이옴 분야에 진출하고 있다.
CJ제일제당은 2021년 7월 982억원 규모로 천랩을 인수하며 레드바이오 분야로 CJ바이오사이언스를 출범시켰다. 천랩을 이끌었던 천종식 대표가 CJ바이오사이언스 대표직을 수행하며 R&D를 이끌고 있다.
CJ바이오사이언스는 키트루다와 병용으로 'CJRB-101'에 대한 임상 1/2상을 FDA로부터 승인 받았다. 여기에 4D파마로부터 마이크로바이옴 기반 신약후보물질 9건은 도입했다. 해당 파이프라인은 고형암, 소화기질환, 뇌질환, 면역질환 등을 타깃으로 한다.
셀트리온은 바이오텍과 손잡고 마이크로바이옴 분야에 진출했다. 고바이오랩과 리스큐어바이오사이언시스와 협업을 통해서다. 타깃 질환은 파킨슨병, 아토피피부염, 과민성대사증후군 등 차별화된 질환 전략으로 접근하고 있다. 셀트리온의 경우 위탁생산(CMO) 역량이 있기 때문에 마이크로바이옴 분야에서 위탁개발생산(CDMO)로 확장해 나갈 수 있을 것이란 분석도 나온다.
투자업계 관계자는 "마이크로바이옴은 아직 신약으로서는 입증해야 할 것이 많지만 건강기능식품 등 단기간내 매출원을 확보할 수 있는 요소가 있는 분야"라며 "대기업은 마이크로바이옴의 신약 가능성 뿐만 아니라 단기 수익성까지 고려해 마이크로바이옴에 인수와 투자를 하는 것으로 보인다"는 의견을 제시했다.
전통 제약회사 역시 마이크로바이옴에 적극적으로 진출하고 있다. 렉라자 이후 후속 파이프라인을 찾는 유한양행은 마이크로바이옴 기업의 지분을 잇달아 인수했다. 최근 마이크로바이옴 기업 프로젠의 최대주주 지분을 확대한 데 이어 지아이바이옴, 메디오젠, 에이티젠에도 투자를 단행했다. 여기에 마이크로바이옴 연구 인력을 뽑으며 자체 개발을 위한 인프라도 구축 중이다.
종근당바이오는 세브란스병원과 마이크로바이옴임상연구센터를 열며 신약개발을 위한 기초연구에 나섰다. 염증성장질환, 알츠하이머 치매, 호흡기 감염질환 등 치료제 미충족 의료 수요가 높은 적응증의 마이크로바이옴 치료제 연구개발에 나선다는 전략이다. 여기에 마이크로바이옴 신약 개발을 전문으로하는 바이오텍으로 지놈앤컴퍼니, 고바이오랩, 지아이바이옴 등이 있다.
또 다른 투자 업계 관계자는 "마이크로바이옴이 후기 임상까지 진행하는 것을 보면 신약 모달리티로서 가치는 충분하다고 판단한다"며 "국내 기업들이 타깃 질환과 균주 및 대사산물에 대한 구체적인 개발 전략으로 접근하면 글로벌 시장에서 충분히 경쟁해 볼 만한다"고 전했다.

< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- [Market Watch]DN솔루션즈 이어 롯데글로벌까지, 대형 IPO '휘청'
- [롯데글로벌로지스 IPO]흥행 실패 우려, 결국 상장 철회로 귀결
- [AACR 2025]제이인츠 'JIN-001', 독성 최소화한 '저농도' 효능 입증
- [Financial Index/SK그룹]주가상승률 50% 상회, SK스퀘어 'TSR' 그룹내 최고
- 금호타이어, 분기 '최대 매출'…영업이익은 '주춤'
- 유지한 SKC CFO "트럼프 관세, 위기보다 기회"
- [i-point]신테카바이오, 'K-BioX 글로벌 SUMMIT 6' 참여
- 간추려진 대명소노그룹 선택지, '티웨이'에 집중
- [감액배당 리포트]제주항공, 신속한 885억 감액…배당은 못했다
- [중간지주 배당수익 분석]세아베스틸지주, 배당수익 3배 급증...분할회사도 첫 기여






















