[HLB '리보세라닙' 미국 진출기]FDA 재도전, 경영진이 말하는 허가 자신감 배경은정세호 엘레바 대표·한용해 HLB CTO "경쟁약 등장해도 차별화 무기"
정새임 기자공개 2025-03-20 09:24:43
이 기사는 2025년 03월 20일 08시30분 thebell에 표출된 기사입니다
HLB그룹 항암 신약 '리보세라닙'이 다시 미국 식품의약국(FDA) 관문 앞에 섰다. 21일 재심사 결과를 앞두고 그룹 내부는 침착한 분위기를 견지하는 중이다.지난해 예기치 못한 보완요구서한(CRL)을 받은터라 추가 CRL이 나올 가능성을 전혀 배제할 순 없다. 시장의 의견도 분분하다. 하지만 재심사 후 FDA 지적사항이 매우 경미했던 터라 내부적으론 허가를 자신하고 있다.
더벨은 심사 데드라인을 3일 앞둔 18일 HLB 본사에서 그룹 최고기술책임자(CTO)를 맡고 있는 한용해 HLB생명과학 대표 그리고 FDA 인허가를 총괄하는 미국 자회사 엘레바의 정세호 대표(사진)를 만났다. 재심사 과정에서 FDA와 논의한 내용, 리보세라닙·캄렐리주맙의 경쟁력을 들었다.
◇마지막 지적사항 '매우 미미', 자신감 드러낸 HLB
HLB가 추진하고 있는 '리보세라닙·캄렐리주맙'의 FDA 재심사 결과는 한국시간으로 20일 밤 또는 21일 새벽께 전달된다. 결과를 받자마자 진양곤 HLB그룹 회장이 유튜브로 소식을 알릴 예정이다.
지난해 CRL을 받은 후 파트너사인 중국 항서제약은 재심사 통과를 위해 제조품질관리(CMC)를 철저히 준비했다. 두 번째 실사를 마치고 받은 지적사항이 매우 경미해 내부적으론 긍정적인 결과를 기대하고 있다. 다만 지난해처럼 예기치 못한 상황이 나올 가능성이 전혀 없지 않기 때문에 차분하게 결과를 기다리고 있다.
한 대표는 "재실사 후 3가지 지적사항이 있었는데 매우 미미한 조항들"이라며 "지난해와 달리 승인에 자신감이 있다"고 말했다.

지난해 FDA가 항서제약 캄렐리주맙 생산기지에서 무균 등 CMC 관련 핵심사항 10가지를 지적했다면 재실사에서는 장비 업그레이드 등 3가지 마이너 사항만 지적했다는 설명이다.
현지 판매와 마케팅을 담당할 엘레바도 승인을 대비해 영업마케팅을 선제적으로 준비하고 있다. 허가 시 7월 빠르게 론칭할 계획이다.
정 대표는 "지난해 10개월 공백을 감안해 관련 인력을 줄였지만 다시 총괄임원을 중심으로 작업을 진행하고 있다"며 "이미 영업마케팅을 위한 제반작업을 충분히 준비한 상태"라고 말했다.
◇"경쟁약물 대비 경쟁력 여전" NCCN 등재여부 주목
리보세라닙·캄렐리주맙이 FDA 승인을 받게 되면 HLB는 처음으로 글로벌 상용화 신약을 갖추게 된다. 동시에 엘레바의 역할도 막중해질 전망이다. 국내 제약바이오기업이 미국 현지에서 신약을 직접 판매하는 사례는 매우 드물기 때문이다. SK바이오팜의 '세노바메이트', 셀트리온의 '짐펜트라' 정도다. 각각 뇌전증, 자가면역질환으로 항암 분야에서는 HLB가 첫 도전이다.
규모가 방대한 항암 시장에서 신생 기업과 다름없는 엘레바가 신약을 잘 판매할 수 있을지 우려도 나온다. 정 대표는 "오히려 소규모의 인원으로도 충분히 판매가 가능한 쪽이 항암 시장"이라고 자신감을 내비친다. 한국처럼 암 치료에 특화된 특정 병원에 환자가 집중돼있다는 점에서다.
정 대표는 "MD앤더슨, 메모리얼 슬론 케서린 등 대규모 암센터에 환자가 모여있어 의학부나 영업부가 커버할 영역이 광범위하지 않다"며 "또 간암이라는 특정 분야에 집중하기 때문에 소규모 인원으로도 효과적으로 마케팅이 가능하다고 보고 있다"고 설명했다.
허가심사 기간이 길어지면서 간암 치료 시장도 변화가 일어나는 중이다. 가장 최근 위협적인 경쟁약물도 떠오른 것이 BMS의 면역항암제 옵디보·여보이 병용요법이다. 3상 임상에서 리보세라닙·캄렐리주맙과 유사한 23.7개월의 전체생존기간(OS)을 보였다. 옵디보·여보이는 최근 유럽에서 허가를 받았고 다음달 내 미국에서도 허가가 점쳐진다.
한 대표는 옵디보·여보이 등장에도 리보세라닙·캄렐리주맙 요법의 경쟁력은 변함없다고 자신한다. 각각의 임상에서 대조군 대비 차이를 봤을 때 리보세라닙·캄렐리주맙이 훨씬 더 큰 사망위험 감소를 보였다는 점에서다.
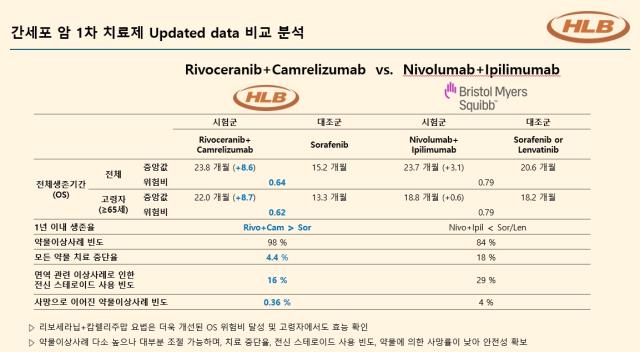
그는 "BMS 임상은 넥사바·렌비마를 대조군의 OS가 20.6개월로 위험비(HR) 0.79를 기록했으며 이는 사망 위험을 21% 낮췄다는 의미"라며 "리보세라닙 임상의 HR은 0.64로 사망 위험을 36%나 줄였다"고 설명했다.
이어 그는 렌비마가 포함된 BMS 임상에서 대조군의 데이터가 더 잘 나올 수 있다는 점을 인정하면서도 "리보세라닙 임상엔 간 기능이 상대적으로 나쁜 환자들이 더 많이 포함됐으며 65세 이상 환자에서도 효과를 보였다는 점에서 65세 이상 환자에서 차이가 없었던 BMS 임상과 차이가 있다"고 말했다.
기전상 부작용에서도 차이를 보인다. 옵디보·여보이는 항PD-1과 항CTLA-4 기전의 면역항암제 조합이다. 반면 리보세라닙·캄렐리주맙은 항VEGFR1·2·3 표적항암제와 항PD-1 면역항암제 조합이다. 기전상으로 보면 현재 가장 널리 쓰이는 로슈의 티쎈트릭·아바스틴 조합과 유사하다.
한 대표는 "항CTLA-4는 독성이 강해 초기에만 잠깐 투여하면서 스테로이드를 같이 쓰는 방식을 주로 택하다 보니 초반 치료효과가 나기 어렵다"며 "캄렐리주맙은 2주마다 투여할 정도로 혈중 반감기가 상대적으로 짧고 그만큼 부작용을 관리하기가 쉽다는 장점이 있다"고 덧붙였다.
허가를 받는다면 마케팅 키 포인트는 미국암종합네트워크(NCCN) 가이드라인 등재가 될 것으로 전망된다. NCCN은 암종별 최적의 치료를 위해 최신 데이터를 중심으로 상시 업데이트되는 글로벌 가이드라인이다. 최상위 등급인 '카테고리1(우선권고)'로 등재되면 1차 치료 처방의 강력한 근거자료가 된다.
정 대표는 "허가를 받는다면 리보세라닙·캄렐리주맙의 NCCN 등재에 최우선 주력할 것"이라며 "이를 기반으로 현지 의료진에게 새로운 요법을 알릴 예정"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [김화진칼럼]영국 RBS
- '환경 변화 고려' CJ제일제당, 그린바이오사업 계속 키운다
- [DN솔루션즈 IPO]고심끝 상장 철회…비우호적 시장 환경에 '결단'
- [i-point]신테카바이오, ‘2025 글로벌 IP 스타기업’ 선정
- [i-point]채비, 서울시 전기버스 충전 인프라 확대 사업자 선정
- [영상/Red & Blue]현대엘리베이터 '주주환원, 리포트, 실적' 삼박자
- 기지개 켜는 인성정보의 '헬스케어'
- [i-point]인텔리안테크, 정부 저궤도 위성통신망 구축 '핵심'
- [NHN 리빌딩]'아픈 손가락' 콘텐츠, 더디지만 잠재력 확신
- [영상]‘메타가 탐낸’ 퓨리오사AI의 백준호 대표에게 들었다…회사의 향후 계획은
정새임 기자의 다른 기사 보기
-
- [차바이오텍 유상증자 용처 분석]R&D 자금 사수 배경, 신규 영입 남수연 사장에 쏠린 기대
- [AACR 2025 프리뷰]만성질환에서 항암으로 뻗는 대웅제약, 3종 신약 '출사표'
- [2025 제약·바이오 포럼]한국 협업 기회 찾는 노바티스, 혁신 '기전·모달리티' 주목
- 피노바이오, 최성구 전 일동제약 사장 사외이사 영입
- 조병철의 다안바이오, 또 기술이전 지씨셀에 'CAR 항체'
- [AACR 2025 프리뷰]오픈이노베이션 입증의 시간, 리가켐·에이비엘·루닛 주목
- [AACR 2025 프리뷰]일동제약의 신약 첨병 아이디언스, 4종 물질 첫 공개
- 성숙기 접어든 KDDF, 지원과제 늘리고 투자유치 스퍼트
- [AACR 2025 프리뷰]신약 개발 속도내는 제이인츠바이오, 연구 2건 출격
- [AACR 2025 프리뷰]국내 항암 신약 투톱 유한양행·한미약품, '최다' 기록 쓴다






















