신라젠, '펙사벡' 이어 7년 만 국내 본임상 진입 '바실리아 L/I' 회사 첫 저분자화합물… 시장 신뢰 회복 첫단추 주목
최은수 기자공개 2023-04-18 09:56:41
이 기사는 2023년 04월 17일 08시03분 thebell에 표출된 기사입니다
신라젠이 개발중인 진행성 고형암 환자 대상 파이프라인 'BAL0891'의 국내 본임상시험계획(IND)을 승인받았다. 그간 유일했던 본임상 프로그램이자 핵심 파이프라인 '펙사벡'의 글로벌 임상 좌초 이후 7년 만에 본임상 진입 사례를 만들어냈다.시장에선 항암바이러스 중심 파이프라인에서 다각화를 꾀하려 했던 신라젠이 소기의 성과를 거둔 점에 주목하는 모습이다. 또 BAL0891이 그간 여러 항암신약 성과를 만들어낸 저분자화합물 모달리티(치료기줄)에 해당하는 점 등을 고려해 이번 본임상 진입을 회사가 신뢰 회복의 첫단추를 꿴 것으로 판단하는 분위기다.
◇펙사벡 이후 7년 만의 본임상… '후속 파이프라인 확충' 시장 기대감 충족
신라젠은 식품의약품안전처로부터 진행성 고형암 환자 대상의 'BAL0891' 단독요법과 화학요법과의 병용에 대한 임상시험계획(IND)을 승인받았다고 14일 밝혔다. 이번 임상은 진행성 고형암이 있는 성인 환자를 대상으로 'BAL0891' 단일요법 및 카보플라틴 또는 파클리탁셀과 병용요법을 하는 임상 1상이다.
신라젠은 임상을 통해 BAL0891 단독요법의 안전성, 내약성, 약동학 평가와 항암 효과 등을 확인한다. 더불어 중간 분석 결과를 기준으로 더 많은 환자군을 대상에 안전성과 효능을 평가할 지를 가늠할 계획이다.
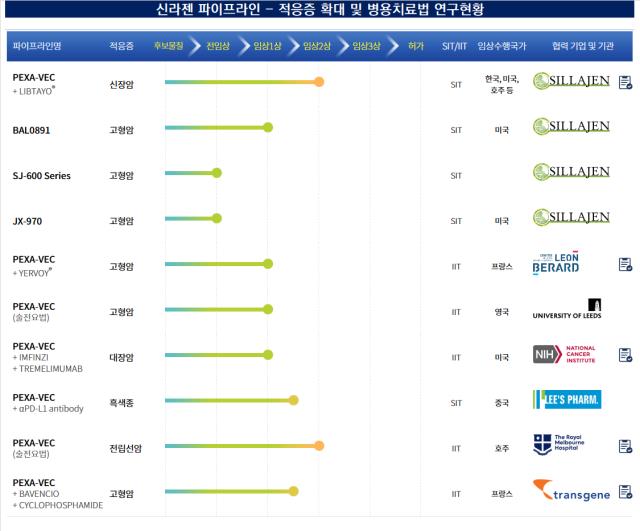
신라젠으로선 7년 만에 국내 본임상 문턱을 넘었다. BAL0981 이전 신라젠의 처음이자 마지막 국내 본임상은 2016년 4월 진행성 간세포암(HCC) 타깃 펙사벡(Pexa-vec) 글로벌 임상 3상(총 600명, 국내 125명 대상)이었다. 다만 해당 임상은 2019년 8월 미국 독립적 데이터 모니터링 위원회(IDMC)로부터 중단 권고를 통지받고 개발에 최종 실패했다.
BAL0891의 본임상 진입이 시장에서 주목받는 것은 신라젠이 그간 지나치게 펙사벡 하나만 바라보고 달려왔던 것과도 무관치 않다. 특히 2019년 펙사벡의 간암 임상이 무위로 돌아갔을 당시에만 해도 이렇다 할 상용화를 기대할 만한 후속 파이프라인이나 촉매제(Catalyst) 자체가 전무했던 상황이었다.
업계 관계자는 "펙사벡에 모든 회사 역량이 쏠렸던 점은 한 때 15조원을 넘던 시가총액이 10분의 1토막 나고 거래정지와 대주주 손바뀜까지 지난한 과정을 거친 배경이기도 하다"며 "시장에선 엠투엔으로 최대주주가 바뀐 이후 포트폴리오 다각화 등 변화하는 모습을 기대해 왔는데 이에 부응한 것"이라고 말했다.
◇유전자재조합 아닌 '저분자화합물' 모달리티… 트렌드보다 실리·신뢰 회복 중점
'BAL0891'은 신라젠이 지난해 스위스 제약사 바실리아로부터 총 계약금 3억3500만달러(한화 약 4370억원), 선급금 200억원에 기술도입(L/I)한 항암 후보물질이다. 라이선싱 규모 및 선급금을 통해서도 펙사벡 이후 새롭게 주력하는 신규 파이프라인에 대한 신라젠의 기대감을 엿볼 수 있다.
BAL0891의 세부적인 모달리티는 저분자화합물(Small Molecule), 합성신약인 것으로 확인된다. 아직 타깃하는 세부 적응증을 확정하기 전이다. 신라젠 측에선 삼중음성유방암, 자궁내막암, 대장암, 요로상피암, 위암, 신장암 등 다양한 암세포주에서 효능을 나타냈다고 밝혔다.
그간 신라젠이 유전자재조합 바이러스(항암바이러스)기술을 앞세웠던 것을 고려하면 BAL0891은 회사의 R&D 정체성과는 궤를 달리한다. 다만 또 다른 항암바이러스 파이프라인 SJ-600에 기대를 걸기엔 리스크가 지나치게 크다는 내부 판단을 내리고 모달리티를 선회한 모습이다.
SJ-600 모달리티가 항암바이러스인 만큼 앞서 '펙사벡'을 중심에 뒀던 신라젠 R&D 연속성 측면에선 나쁘지 않은 선택지로 볼 수 있다. 다만 SJ-600이 아직도 전임상 단계에 있는 초기 물질인 점, 항암바이러스로 미국 FDA에서 신약승인을 받은 사례 자체가 제한적(2015년 암젠의 Imlygic 1건)인 것도 종합적으로 고려한 것으로 보인다.
신라젠 관계자는 "국내 규제기관에도 BAL0891의 임상 1상을 승인한 만큼 향후 성과 창출에 주력할 계획"이라며 "시장 신뢰 회복을 기초로 삼고 미충족 수요가 높은 항암 시장을 공략할 신약으로 발돋움할 수 있도록 노력하겠다"고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- [Market Watch]DN솔루션즈 이어 롯데글로벌까지, 대형 IPO '휘청'
- [롯데글로벌로지스 IPO]흥행 실패 우려, 결국 상장 철회로 귀결
- [AACR 2025]제이인츠 'JIN-001', 독성 최소화한 '저농도' 효능 입증
- [Financial Index/SK그룹]주가상승률 50% 상회, SK스퀘어 'TSR' 그룹내 최고
- 금호타이어, 분기 '최대 매출'…영업이익은 '주춤'
- 유지한 SKC CFO "트럼프 관세, 위기보다 기회"
- [i-point]신테카바이오, 'K-BioX 글로벌 SUMMIT 6' 참여
- 간추려진 대명소노그룹 선택지, '티웨이'에 집중
- [감액배당 리포트]제주항공, 신속한 885억 감액…배당은 못했다
- [중간지주 배당수익 분석]세아베스틸지주, 배당수익 3배 급증...분할회사도 첫 기여
최은수 기자의 다른 기사 보기
-
- [Financial Index/LG그룹]그룹 자존심 지킨 에너지솔루션, 2024년 PBR '3.86배'
- [Financial Index/LG그룹]'자본 2000억' HS애드, 2024년 유일한 10%대 이익률
- [Financial Index/롯데그룹]순현금 상태 기로 선 정밀화학, 7조 차입 버거운 지주
- [Financial Index/롯데그룹]리츠 분전에도 역부족, 지주 이자보상배율 1배 하회
- [비상장사 재무분석]'L/O 계약금 추가 기대' ATGC, 15년만에 턴어라운드
- [Financial Index/롯데그룹]'4조 매출' 롯데칠성, 그룹 상장사 성장률 1위
- [Financial Index/롯데그룹]'불황에 강했다' 롯데렌탈, 나홀로 TSR 상승
- [Financial Index/롯데그룹]주요 계열사 PBR 1배 밑…음료까지 부진
- [재무 리스트럭처링 전략]롯데지주, ICF 5년 만에 순유입…보유현금도 양호
- [Financial Index/롯데그룹]상장계열사 11곳 중 8곳 이익률 후퇴 '고난의 2024년'






















