[클리니컬 리포트]쎌바이오텍, 마이크로바이옴 대장암 타깃 국내 첫 임상PP-P8, 식약처 임상 1상 IND 2년만에 승인…관련 적응증으로 첫 케이스
김형석 기자공개 2024-03-22 08:41:39
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2024년 03월 21일 16:31 thebell 에 표출된 기사입니다.
유산균 전문기업 쎌바이오텍이 마이크로바이옴 기반의 대장암 신약 임상에 시동을 건다. 다수의 자체 개발 유산균 기술력을 바탕으로 정체국면에 있는 마이크로바이옴 신약개발 시장에 선도기업이 되겠다는 포부다.◇ 2년 만에 IND 승인…내약성 평가 빠르게 마무리 예정
쎌바이오텍은 20일 국내 식품의약품안전처로부터 대장암 신약 ‘PP-P8’의 1상 임상시험계획(IND)을 승인받았다. 이번 승인은 IND를 신청한 지 약 2년 만이다.
중증 단계의 대장암 환자 32명을 대상으로 △내약성 평가 △안전성 평가 △유효성 탐색 등을 진행한다. 용량 증량 단계인 파트1에서 최대 12명이 대상이다. 용량 확대 단계인 파트2에서는 최대 20명을 모집한다. 파트2에서는 파트1에서 확인된 최대내약용량 또는 권장용량(RP2D)을 투여한다. 예상 임상기간은 24개월이다.
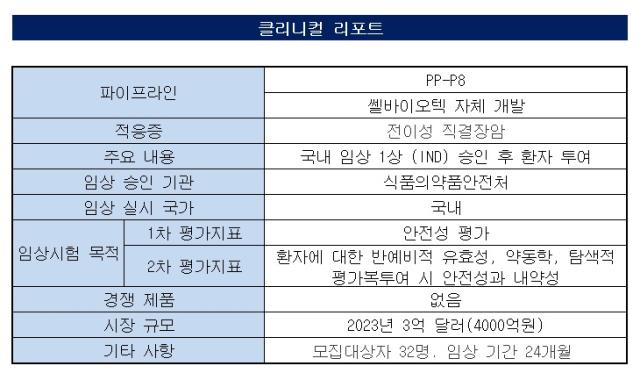
PP-P8은 한국산 유산균을 활용한 마이크로바이옴 기반의 경구용 유전자 치료제다. 기존에 나왔던 약물들과 전혀 다른 혁신 신약(First-in-Class)이다. 유전자 조작 기술을 활용해 대장암세포를 죽이는 항암 단백질 P8을 자연 상태보다 약 100배 이상 생산할 수 있다.
자체 특허 균주 ‘CBT-LR5(Lactobacillus Rhamnosus CBT-LR5, KCTC 12202BP)’ 유래 항암 단백질 ‘P8’을 대량 복제 생산하는 ‘CBT-SL4(Pediococcus Pentosaceus CBT-SL4, KCTC 10297BP)’의 유전자를 재조합해 PP-P8를 개발했다.
이 물질은 대장암세포 내로 침투한 P8이 대장암 증식에 관여하는 세포의 주기정지 표적 GSK3β 단백질에 결합한다. 이는 성장촉진 단백질을 파괴해 대장암세포의 증식을 억제하는 항암 작용기전(MOA)을 효과를 낸다.
쎌바오텍이 지난해 7월 SCI급 학술지 국제분자과학저널(International Journal of Molecular Sciences)에 PP-P8 연구결과를 게재했다.
쎌바이오텍은 유산균 약물전달시스템(DDS)과 항암 치료용 재조합 유산균 등 기술 플랫폼을 활용해 향후 당뇨 치료제, 위암 치료제 등 다양한 연구 개발 파이프라인으로 신약 개발을 확대할 예정이다.
◇ 마이크로바이옴 대장암 치료제 국내 처음…시장 선점효과 기대
마이크로바이옴은 유전체 분석(유전자 서열 분석 등)을 비롯한 다양한 오믹스(omics) 분석법이 등장하며 질환을 치료할 수 있는 물질로 개발되고 있다. 이미 인간의 몸 속에 오랫동안 공생해 온 균주이기 때문에 안전성 측면에서 다른 의약품 대비 이점을 갖는다. 반면 기대만큼 약물 효능에서 유의미한 결과를 얻지 못했다.
이 때문에 과거 마이크로바이옴 업계는 이렇다할 결과물을 내지 못했다. 업계 대표 주자인 핀치 테라퓨틱스, 이벨로 바이오사이언스, 베단타 바이오사이언스 등은 임상에서 통계적 유의성을 달성하지 못하고 인력 감축 등 구조조정을 단행하기도 했다.
국내 역시 관련 연구는 초기 단계에 머물러 있다. 가장 앞서있는 파이프라인은 임상 2상을 진행한 지놈앤컴퍼니의 위암 치료제 'GEN-001'과 고바이오랩의 건선 신약 'KBLP-001' 정도다.
대장암을 타깃으로 임상에 돌입한 마이크로바이옴 물질은 PP-P8이 유일하다. 마이크로바이옴 시장에서 독점적 위치를 가진 기업이 없는 만큼 이번 임상 결과에 따라 쎌바이오텍이 관련 업계 선두주자로 자리매김할 수 있다.
쎌바이오텍 관계자는 "이미 지난해 말 식약처가 요구한 추가 자료를 제출한 만큼 IND 승인이 가능할 것으로 예상하고 있었다"며 "이번 임상1상 결과를 기반으로 빠르게 임상2상도 진행할 계획"이라말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- ICTK, 일반청약 경쟁률 1108대1 '증거금 5.4조'
- [Company Watch]인적분할 나선 서진시스템, 신설법인에 ESS사업 배정
- 골리앗에 맞선 이오플로우, '인슐렛' 소송전 청신호
- [Red & Blue]지투파워, 한수원 체코 원전 수주시 납품 기대감
- 공모 시총 3000억 육박한 ICTK, 기관투자가 '웃음꽃'
- [CVC 톺아보기]'카카오' 계열 편입 '기폭제', 그룹 지원 속 폭풍 성장
- 두산건설, '반도체 메가 클러스터' 수혜 단지 분양
- [코스닥 리빌딩 리포트]1000억 CB 공수표 날린 퀀타피아, 공개매각 추진
- 올리패스 잠재 대주주 사내이사로…수익성 확보 총력
- '대유타워 매각' 대유위니아, 새 원매자 찾기 시동
김형석 기자의 다른 기사 보기
-
- 동아쏘시오, 분기 최대 매출…계열사 덕봤다
- 동아에스티, 의료파업 악재 해외·ETC로 극복
- 웰트, 한독빌딩으로 이전…불면증 치료제 개발 가속화
- [피플人 제약바이오]국제약품의 '안질환' 타깃, CTO가 밝힌 이유있는 자신감
- 하나제약, 제네릭 진통제 출시 포기…성장전략 '삐끗'
- 온코닉테라퓨틱스 이사회, 오너 빼고 사외이사 늘리고
- [2024 제약·바이오 포럼]글로벌 네트워크 구축, 한국 바이오 퀀텀점프 선결조건
- CG인바이츠, 화일약품 지원 축소 11년 동행 '선긋기'
- [thebell note]제약바이오는 다이어트 중
- [제약사 TSR 분석]제일약품, '주가·실적·배당' 3중고 열쇠 '온코닉의 신약'





















