[레켐비로 보는 치매 시장]아리바이오의 도전 '발기부전 치료제 약물재창출'⑧'PDE-5 억제' 미로데나필 다중기전 전면에… 미국 이어 국내·유럽 등 MRCT 눈앞
최은수 기자공개 2023-08-07 12:28:55
[편집자주]
2만6000달러의 기적. 에자이와 바이오젠이 아두헬름에 이어 내놓은 '두 번째' 알츠하이머 신약 레켐비를 둔 해외시장의 평가다. 레켐비는 효능과 안전성에 의문부호가 붙어 있다. 그러나 근본 치료제로서의 위상을 흔들 이슈로는 보기 어렵다. 국내 시장 역시 레켐비를 구심점으로 급변하는 시장 분위기를 예의주시하고 있다. 이제 막 열린 치매 시장에 선 국내 제약바이오 업계의 대응 전략을 살펴본다.
이 기사는 2023년 08월 03일 08:27 thebell 에 표출된 기사입니다.
아리바이오는 알츠하이머 치료제 개발에서 오랫동안 '문제적 회사' 위치에 서 왔다. 2010년 설립 후 주력하던 화장품·건기식 사업을 내려놓고 총 4개의 치매 파이프라인을 확보하며 사업전환을 선언했다. 그러나 최소 후기 임상 프로그램을 보유하고도 국내 기술성평가를 통한 코스닥 입성 문턱을 넘지 못하며 분루를 삼켰다.핵심 파이프라인 'AR1001'의 성분명은 미로데나필이다. PDE-5를 억제하는데 기존엔 발기부전치료제로 자주 쓰였다. 알츠하이머와는 거리감이 있어보이지만 그간 임상에서 다중기전과 관련한 객관적 데이터를 공개했다. SCI급 논문을 통해 발표된 그간 AR1001의 유의성과 효능을 전 세계 1200명 이상의 임상환자를 통해 입증하는 게 다음 과제다.
◇'비아그라로 유명세' PDE-5 억제제의 변주… 의미 있는 유효값 확보→ MRCT 진입
아리바이오는 2010년 설립 후 약 10년간은 화장품 및 건강기능식품 사업에 주력했다. 2018년 코스닥 도전에서 좌절한 이후부턴 치매치료제 개발 바이오텍으로 리브랜딩에 나섰다. 글래스고 대학교 이학박사, 케임브릿지 대학교 생명공학연구소 출신의 정재준 대표를 구심점으로 R&D를 진행 중이다.
리브랜딩이나 피봇팅 과정이 VC나 FI를 중심으로 성장하는 여타 바이오텍처럼 세련되진 않다. 그러나 결과적으로 건기식 이미지를 벗고 퇴행성뇌질환 치료제 전문기업으로 역량을 쌓는 데는 성공했다. 기존의 화장품 및 건기식 사업을 축소하고 치매 치료 기업 아이덴티티를 강화하는 전략 자체에 정 대표의 '진심'이 담겨 있는 결과로 풀이된다.
퇴행성뇌질환 파이프라인은 총 5가지다. 미로데나필 성분의 AR1001, 타우 병변 알츠하이머병, 레트 증후군 치료제인 AR1002, 복합제인 AR1003, 천연물(생약)인 AR1004, (루이소체 치매를 타깃하는 AR1005 등이 있다.
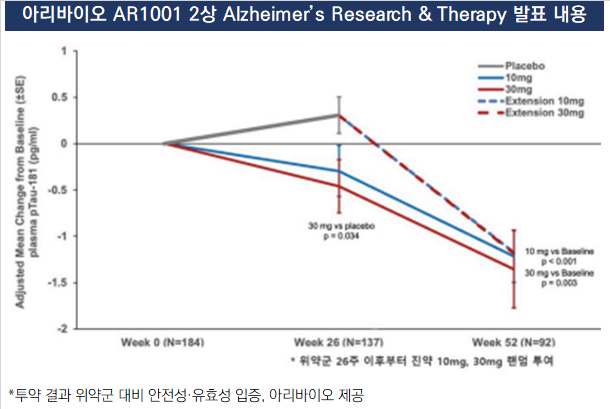
이중 가장 성과가 앞선 것은 AR1001이다. 기전은 PDE-5 억제(inhibitor)를 통한 CREB·Wnt·Autophagy 활성화다. 기전은 복잡하나 PDE-5 인히비터 약물 재창출 가능성은 오랫동안 학계에서 관심을 두던 영역이다. 역시 발기부전 치료제로 개발한 PDE-5 억제제의 아이콘인 화이자의 비아그라(성분명 실데나필) 역시 차츰 알츠하이머 치료제로의 가능성을 모색하고 있다.
AR1001은 목표 환자 규모만 1500명에 달하는 다국가간임상(Multi Region Clinical Trial, MRCT) 3상을 계획 중이다. 임상 2상까지의 데이터는 긍정적이다. 3점 이상 인지기능 개선을 보이면 인정받는 유효성지표(ADAS-Cog 13)에서 세부 시험군이 9.2점의 개선을 보였다. 관건은 1000명이 넘는 MRCT에서도 같은 값을 확인하는 것이다.
일단 미국에선 FDA 승인을 통해 작년 12월 첫 3상 환자 투약을 시작했다. 미국 내 알츠하이머 치료제 임상 경험이 많은 약 75개 임상센터를 중심으로 총 모집 인원은 600명 (투약군 300명 AR1001 30mg 투여, 대조군 300명 위약 Placebo 투여)을 대상으로 52주간 투약한다.
◇국내 파트너로는 삼진제약 낙점… 2025년 임상 완료 전 L/O 전략도 병행
아리바이오는 작년에만 1345억원을 조달하면서 임상 비용을 댔다. 기존에도 유상증자와 전환사채(CB)를 통해 틈틈이 자금을 확충해 왔다. 올해 1분기 말 기준 여전히 1000억원 이상의 유동성이 뒷받침됐다. 당분간은 계획했던 임상을 수행하기 위한 체력 고갈에 대한 우려는 낮아 보인다.
사업 전환 이후 퇴행성질환 치료제 개발을 위한 지경을 넓히는 데는 성공했지만 2027년을 목표로 하는 상업화까진 아직 길이 멀다. 임상 이후의 '넥스트'에 대한 구체화도 필요했다. 먼저 국내에선 중견제약사인 삼진제약과 기술경영동맹 협약을 체결하며 파트너십을 강화한 것도 이같은 고민과 무관치 않다.
삼진제약은 아리바이오의 다중기전 경구용 치매 치료제 ‘AR1001’ 국내 임상을 주도할 예정이다. 또 아리바이오가 식약처로부터 AR1001 품목허가를 획득할 경우, 국내 판매 권리에 대한 우선적 지위를 가지게 된다.
AR1001의 국내 임상 소식도 곧 확인할 수 있을 전망이다. 올해 6월 AR1001의 임상3상 신청 (IND)을 완료했다. 분당서울대병원 (신경과)을 중심으로 국내 주요 의료기관과 치매센터에서 임상 환자 모집이 이루질 예정이다. 국내 임상 프로토콜 설계와 개발, 임상 전반을 기술경영 동맹사인 삼진제약과 공동 주관하고 진행하게 된다.
파트너 확보에도 찾아올 수 있는 임상비용 및 개발, 상업화 부담은 라이선스아웃(L/O)을 통해 해소할 계획이다. 올해 5월 글로벌 빅파마와 비밀유지계약(CDA)을 체결하면서 소통을 시작한 계 일례다.

< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 경남제약 품는 휴마시스, 유통네트워크·진단키트 '시너지'
- [Company Watch]글로벌텍스프리, 프랑스 자회사 '적자 전환'
- [Red & Blue]'주목도 높아지는 폐배터리' 새빗켐, 침묵 깨고 반등
- [HLB '리보세라닙' 미국 진출기]시장 우려 불식 나선 진양곤, 갑자기 마련된 기자회견
- 효성화학 특수가스 사업부, '경영권 지분 매각'으로 선회
- 한양, 만기도래 회사채 '사모채'로 차환한다
- 동인기연, 'GS 출신' 30년 베테랑 전호철 상무 영입 '성장 방점'
- 에스트래픽, 적자 '일시적 현상'... 2분기 수익개선 기대
- [Company Watch]'자회사 회생신청' 투비소프트, 성과 없는 신사업
- '크라우드 펀딩' 와디즈, '테슬라 요건' 상장 추진
최은수 기자의 다른 기사 보기
-
- [HLB '리보세라닙' 미국 진출기]시장 우려 불식 나선 진양곤, 갑자기 마련된 기자회견
- [HLB '리보세라닙' 미국 진출기]허가 불발, CRL 수령…진양곤 회장 "리보세라닙 문제 아냐"
- [베일 벗은 통합 셀트리온]셀트리온, 짐펜트라가 신약? 혁신신약 '오픈이노베이션' 말곤 답없다
- [HLB '리보세라닙' 미국 진출기]아바스틴 왕위 잇는 '간암 타깃' 올인, '병용'으로 길 열었다
- 유한양행, '넥스트 렉라자 찾아라' 기술교류 활발
- [이오플로우 '인슐렛' 소송 청신호]이오플로우, 골리앗과 미국 대결 우위…빅딜 불씨 되살린다
- 뉴라클사이언스, 상장·M&A 옵션 건 '프리 IPO' 유치
- [thebell note]바이오 '스타 애널리스트 CFO 시대'의 일몰
- 대웅제약, 편두통 보톡스 '플라시보' 부담에도 3상 간다
- [베일 벗은 통합 셀트리온]통합 후 첫 실적, 역대 최대 매출? 착시효과 해소는 '아직'






















